肿瘤细胞与免疫细胞之间的交互作用是肿瘤免疫微环境的核心。虽然肿瘤细胞对免疫细胞的调节作用在大多情况下是为了建立免疫抑制微环境从而实现免疫逃逸,但是在某些特定条件下的肿瘤细胞死亡(如免疫原性死亡,immungentic cell death)则能促进免疫细胞对肿瘤细胞的识别而激活特异性抗肿瘤免疫响应。因此,靶向放大肿瘤细胞的免疫原性死亡成为肿瘤治疗的重要方向。目前,只有一些治疗手段如光动力治疗、放疗、以及某些小分子细胞毒性药物能够通过增加细胞内的内质网应激压力引起细胞的免疫原性死亡。然而,光动力治疗和放疗等手段需要借助外加刺激实施,主要适合浅表肿瘤的治疗;而小分子细胞毒性药物缺乏特异性,对免疫细胞和正常细胞具有同样的杀伤作用,影响免疫系统的功能发挥。因此,发展利用肿瘤微环境特征特异性触发肿瘤细胞免疫原性死亡的治疗方法对于肿瘤免疫治疗的实施具有重要意义。
基于上述考虑,中国科学院长春应用化学研究所陈学思院士团队以聚合物分子工程理念为指引,结合Passerini三组分反应和铜催化的Huisgen环加成反应,在长循环载体材料聚(L-谷氨酸)-接枝-聚(乙二醇)单甲醚上引入增强氧化应激功能模块,设计制备了肿瘤特异性增强氧化应激高分子共轭物(Tumor Specific Enhanced Oxidative stress Polymer conjugate,TSEOP),用于激活肿瘤特异性抗肿瘤免疫响应。该两亲性TSEOP能够自组装成纳米胶束,在血液中具有长循环能力和肿瘤富集能力。当到达肿瘤组织并被肿瘤细胞摄取后,TSEOP能够在肿瘤特异生理条件刺激下,降解产生肉桂醛(CA)和醌甲基化合物(QM),分别作为活性氧(ROS)产生器和谷胱甘肽(GSH)的消除器,协同增进肿瘤细胞内的氧化应激和内质网压力,引起细胞的免疫原性死亡,并激活后续的特异性抗肿瘤免疫响应(图1)。

图1. TSEOP的合成及其用于诱导肿瘤细胞发生免疫原性死亡并激活特异性抗肿瘤免疫响应的示意图。
体外实验中,TSEOP处理CT26肿瘤细胞能够引起细胞内ROS水平显著升高以及GSH水平的降低,引起肿瘤细胞的凋亡。而在相同条件下,TSEOP对正常细胞的毒性明显低于肿瘤细胞。TSEOP对肿瘤细胞与正常细胞的毒性差异可能有两个原因:(1)TSEOP的肿瘤特异性敏感设计使其在正常细胞中释放CA和QM的速度慢于肿瘤细胞;(2)正常细胞对氧化应激的敏感性一般不如肿瘤细胞。进一步,他们发现TSEOP的处理可以引起CT26肿瘤细胞内高迁移率族蛋白B1(HMGB1)和ATP的释放,增加肿瘤细胞表面钙网蛋白(CRT)的暴露。上述三要素的改变证明了细胞免疫原性死亡的发生。而用TSEOP处理的肿瘤细胞上清加入小鼠骨髓来源树突状细胞(BMDCs)后,BMDCs中CD80阳性的比例明显升高,表明树突状细胞能够被有效激活(图2)。以上结果表明,TSEOP治疗能有效诱导肿瘤细胞的免疫原性死亡并刺激抗原提呈细胞的活化。

图2.(A-B)不同药物处理后肿瘤细胞内ROS染色及定量结果。(C)不同药物处理后肿瘤细胞内HMGB-1测试。(D)不同药物处理后肿瘤细胞培养基中ATP含量。(E)流式细胞术检测经过不同药物处理后肿瘤细胞的CRT阳性比例。(F)体外BMDCs刺激实验及CD80阳性结果。
在体内治疗实验中,单独使用TSEOP治疗即可非常有效地抑制肿瘤生长,在CT26和4T1两种小鼠肿瘤模型上都取得了100%的肿瘤抑制率,实现了肿瘤的治愈。对治疗后的肿瘤组织进行分析发现,TSEOP的治疗可以显著地提高肿瘤内的CD4+和CD8+T细胞的含量,显著地提高活化的树突状细胞的比例,表明TSEOP治疗可以有效地激活获得性免疫。此外,肿瘤内巨噬细胞的组成也发生了改变,TSEOP治疗组M1/M2巨噬细胞比例增加,表明TSEOP的治疗也引起了肿瘤微环境的改变(图3)。
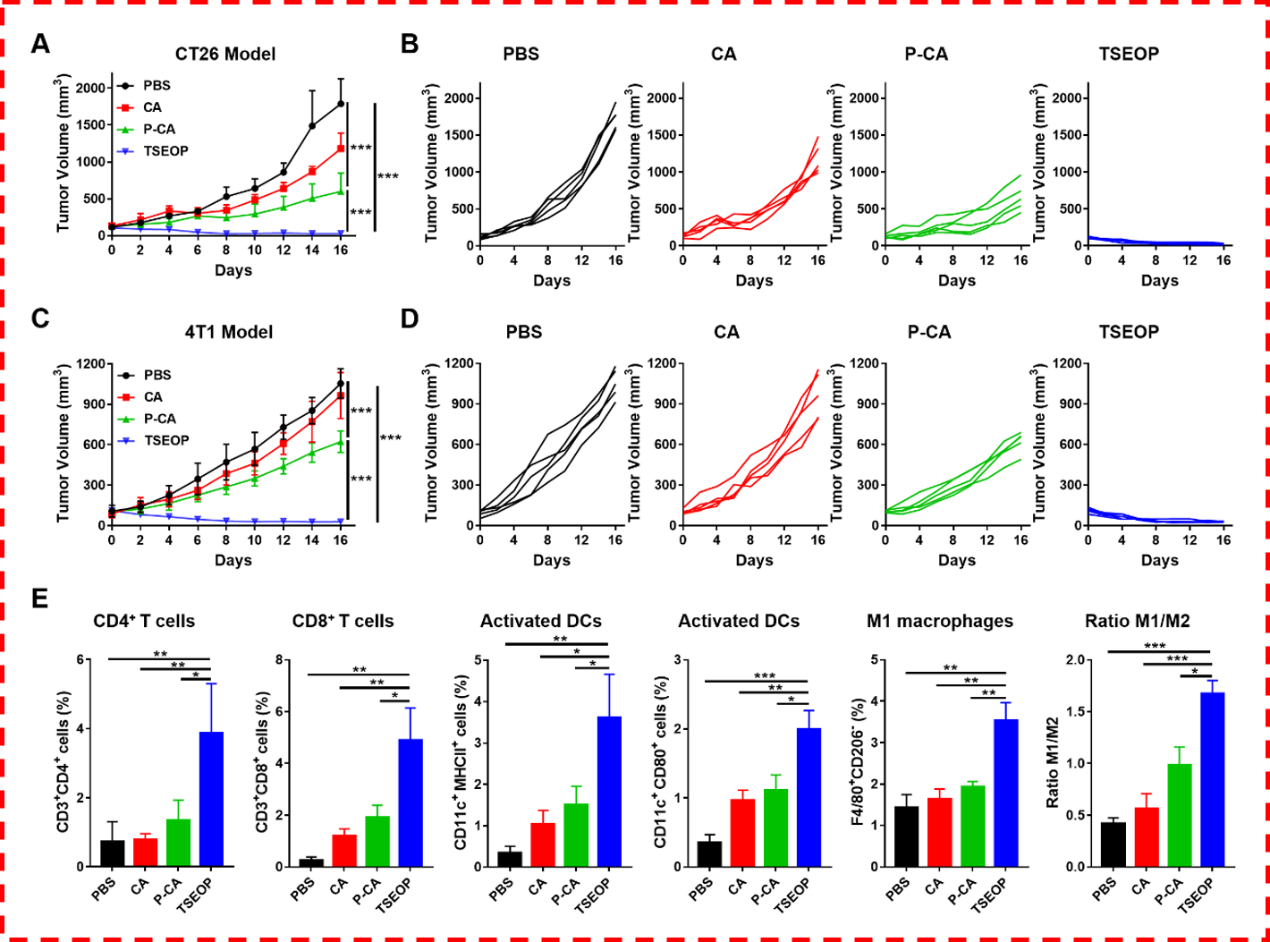
图3. (A-B)不同药物治疗后,CT26肿瘤的肿瘤体积曲线。(C-D) 不同药物治疗后,4T1肿瘤的肿瘤体积曲线。(E)不同药物治疗后,CT26肿瘤组织中免疫细胞含量的变化。
为了证明TSEOP激活了体内肿瘤特异性的抗肿瘤免疫响应,他们在CT26模型上进行了疫苗接种和再挑战实验。他们利用经TSEOP预处理的CT26细胞(TSEOP-CT26细胞)作为疫苗对BALB/c小鼠进行了两次皮下免疫,之后再次种植同种小鼠CT26细胞, 6只小鼠中有4只并没有形成肿瘤。而利用PBS或者未经TSEOP处理的CT26细胞对小鼠进行免疫则没有抑制肿瘤形成的作用(图4)。以上结果证实,TSEOP治疗能有效激活肿瘤特异性的抗肿瘤免疫响应,进而有效抑制肿瘤的生长和复发。
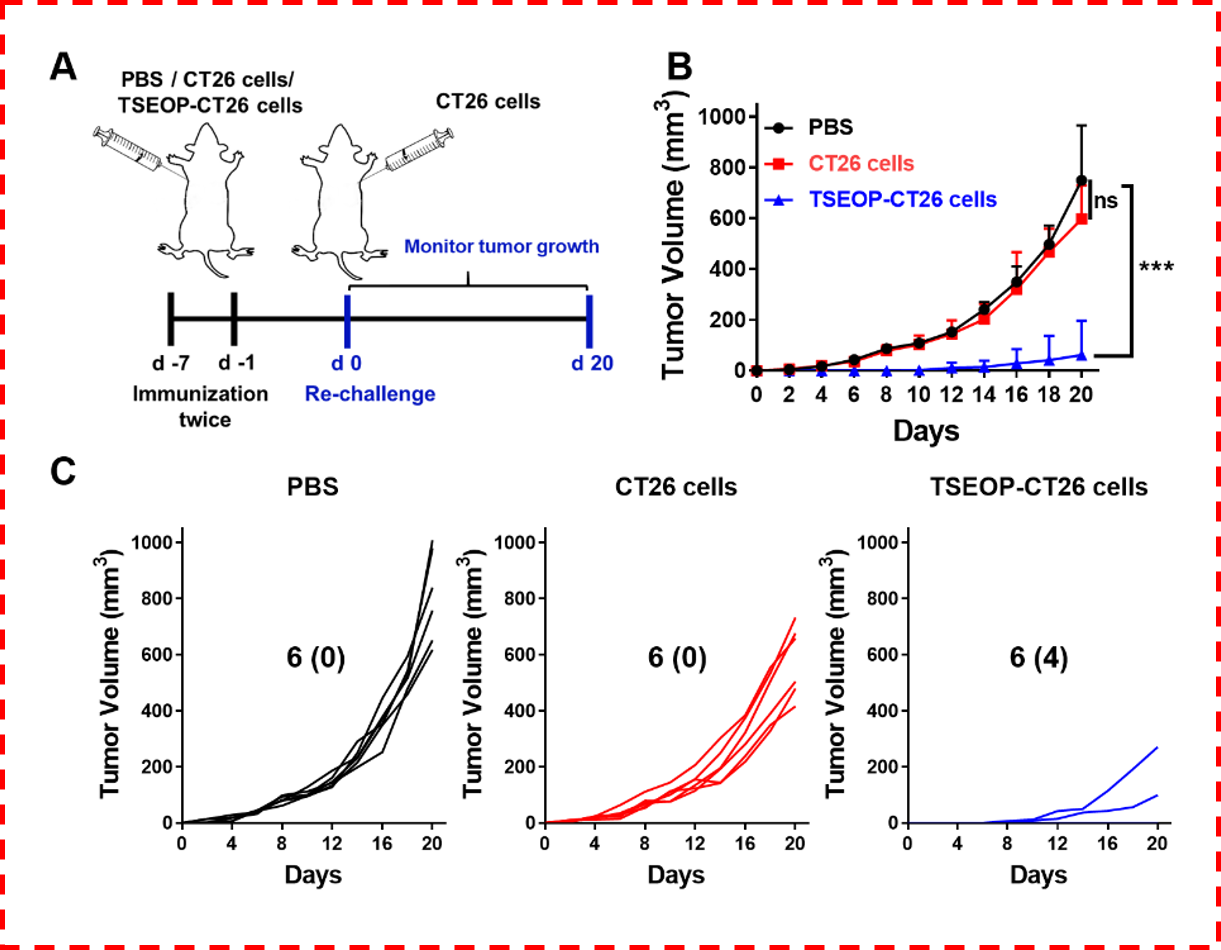
图4. (A) 疫苗接种和再挑战实验设计。(B-C)小鼠接受不同疫苗接种后,再挑战肿瘤的肿瘤体积曲线。
以上研究结果近期发表在Nano Letters上,中科院长春应化所博士生马胜为论文的第一作者,宋万通副研究员和陈学思院士为论文的共同通讯作者。该研究工作得到国家自然科学基金、科技部、吉林省科技发展计划项目,以及复旦大学聚合物分子工程国家重点实验室开放课题的支持。
论文链接https://pubs.acs.org/doi/10.1021/acs.nanolett.9b05265
DOI:10.1021/acs.nanolett.9b05265
- 武汉理工戴红莲/武汉大学喻爱喜 Adv. Mater.:聚柠檬酸双向调节剂 - 协调铁稳态以抑制应激反应并增强线粒体生物能量以促进神经修复 2026-01-05
- 苏州大学冯良珠教授、刘庄教授团队 AFM:温敏催化水凝胶助力酶触“破膜+氧化应激”级联肿瘤消融新策略 2025-12-04
- 福大杨黄浩教授/张进教授、福医大附一医院吴巧艺主任医师 AFM:氧化应激驱动的多模态抗菌电子皮肤贴片用于慢性伤口实时监测与治疗 2025-02-24
- 天工大高辉/余云健团队 ACS Nano:创新纳米酶精准消除肿瘤胞内菌 助力结直肠癌免疫治疗突破 2026-02-20
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 福大林立森/新国大陈小元 Nature大子刊:当手性水凝胶遇上细胞膜仿生-可术后空腔植入的生物杂化水凝胶如何调节肿瘤干细胞信号 2025-12-30
- 山东大学崔基炜教授团队《Adv. Mater.》:“以瘤治瘤”的水凝胶疫苗 - 实现个性化肿瘤免疫治疗新突破 2025-10-09
