由于在实体瘤深层部位缺乏淋巴细胞浸润并且存在多种免疫逃逸机制,因此肿瘤深处逆转免疫抑制对于临床癌症治疗至关重要,但仍然存在巨大挑战。最近,来自中国科大生命科学学院的王育才教授团队与合肥工业大学的王峰教授团队合作在ACS Nano上报道了一种使用第二红外窗口的红外光(NIR(II))光热疗法在实体瘤中触发更均一和更深的免疫原性细胞死亡,从而引发了针对肿瘤控制和转移预防的先天性和适应性免疫应答。在体外,光热处理会导致肿瘤细胞免疫原性死亡(ICD),并伴随着损伤相关分子模式(DAMPs)的释放。在体内,NIR(II)光热导致DAMPs在肿瘤深处的释放和分布更加均匀。NIR(II)光热疗法诱导ICD后可以同时触发了先天性和适应性免疫反应,并实现了有效的肿瘤治疗,其中有5/8的小鼠在肿瘤疫苗接种检测中保持无肿瘤状态。此外,NIR(II)光热疗法与检查点阻断疗法相结合,对原发性和远端肿瘤均进行了长期的肿瘤抑制。最后,使用全身给药的修饰过的2D聚吡咯纳米片(Em@PPy)作为NIR(II)光热试剂,通过协同的光热免疫反应,实现了针对全身肿瘤转移的惊人治疗效果。

图1、示意图显示NIR(II)光热诱导的免疫原性死亡如何促进先天性和适应性抗肿瘤免疫,从而进一步增强α-PD-1检查点阻断免疫治疗。实体瘤的深部和内部具有低pH值,低氧分压,淋巴细胞浸润较少以及免疫逃逸的特征。NIR(II)光热诱导细胞凋亡(#1),随后释放肿瘤相关抗原(TAA)(#2)和DAMPs(#3)。DAMPs促进DC吞噬TAA(#4),从而促进其肿瘤抗原呈递给CD8+ T细胞(#5)并激活TAA特异性细胞毒性T淋巴细胞(CTL)(#9)和记忆T细胞(#10)用于控制肿瘤和预防复发(#11)。从成熟DC(#6)和凋亡肿瘤细胞(#7)释放的细胞因子增加MHC在抗原呈递细胞(APC)上的I类表达,并促进T细胞分化。α-PD-1(#12)的联合递送促进CTL(#13)的增殖和活性,抑制了Tregs细胞和CTL之间的抑制信号(#14和#15),并进一步增强了由NIR(II)光热触发的ICD的治疗作用。ICD诱发的全身性抗癌免疫反应可预防肿瘤转移(#16)。
研究者首先合成采用不同粒径的金纳米颗粒与脂质体DOPC简单混合制备金脂质体复合物Au-DOPC,金纳米颗粒在脂质体表面的聚集可以导致LSPR的红移,而随着金纳米颗粒大小的增加,LSPR的红移也在增加。将直径为15,30和40 nm的AuNPs(即Au15C,Au30C和Au40C)与DOPC混合,产生的聚集体的LSPR位于~660 nm,~800 nm和NIR(II)(~1000nm)窗口(图2)。

图2、可控的AuNPs在脂质体DOPC上自组装可实现不同生物窗口光热
之后,研究了不同生物窗口中的光热是否可以诱导DAMPs从垂死的细胞中释放,这是ICD的最重要特征之一。基于荧光素酶的探针,观察到在45 ℃和50 ℃的光热后4小时内,细胞外ATP从2 nM增加到12 nM,然后在24 h内逐渐降低。FACS检测显示了CALR的暴露是温度依赖性的,CALR在50 ℃ 光热处理后表达最高,在较低温度下降低并且与激光波长大小无关。在激光照射后12 h,50 ℃ 光热处理还显着增加了HMGB1从细胞核到细胞外空间的转运。光热处理后的死亡细胞中上述DAMPs的产生表明光热处理可以诱导温度依赖性ICD表型(图3)。

图3、NIR(II) 光热诱导4T1肿瘤细胞体外释放DAMPs。
接着,研究者对NIR(II)光热在体内诱导免疫原性死亡产生DAMPs表型的能力进行研究。实验结果表明45 ℃和50 ℃ 光热引起细胞骨架和细胞核的形态变化和变形,并且CALR暴露显着增加,幅度为50 ℃ > 45 ℃ > 40 ℃,与体外结果一致。同时,NIR(II)光热处理增加了肿瘤中HMGB1的释放。进一步比较了实体瘤中NIR(I)和NIR(II)激光照射导致ICD 变化。结果显示,对于1064和808 nm激光照射,分别在大约6毫米和3毫米的深度处可以在肿瘤内实现显着的CALR暴露。上述现象证明了使用NIR(II)光热引起DAMPs在更深的肿瘤部位释放的巨大前景,这将在更深的肿瘤中产生更有效的免疫反应和更好的反向免疫抑制(图4)。
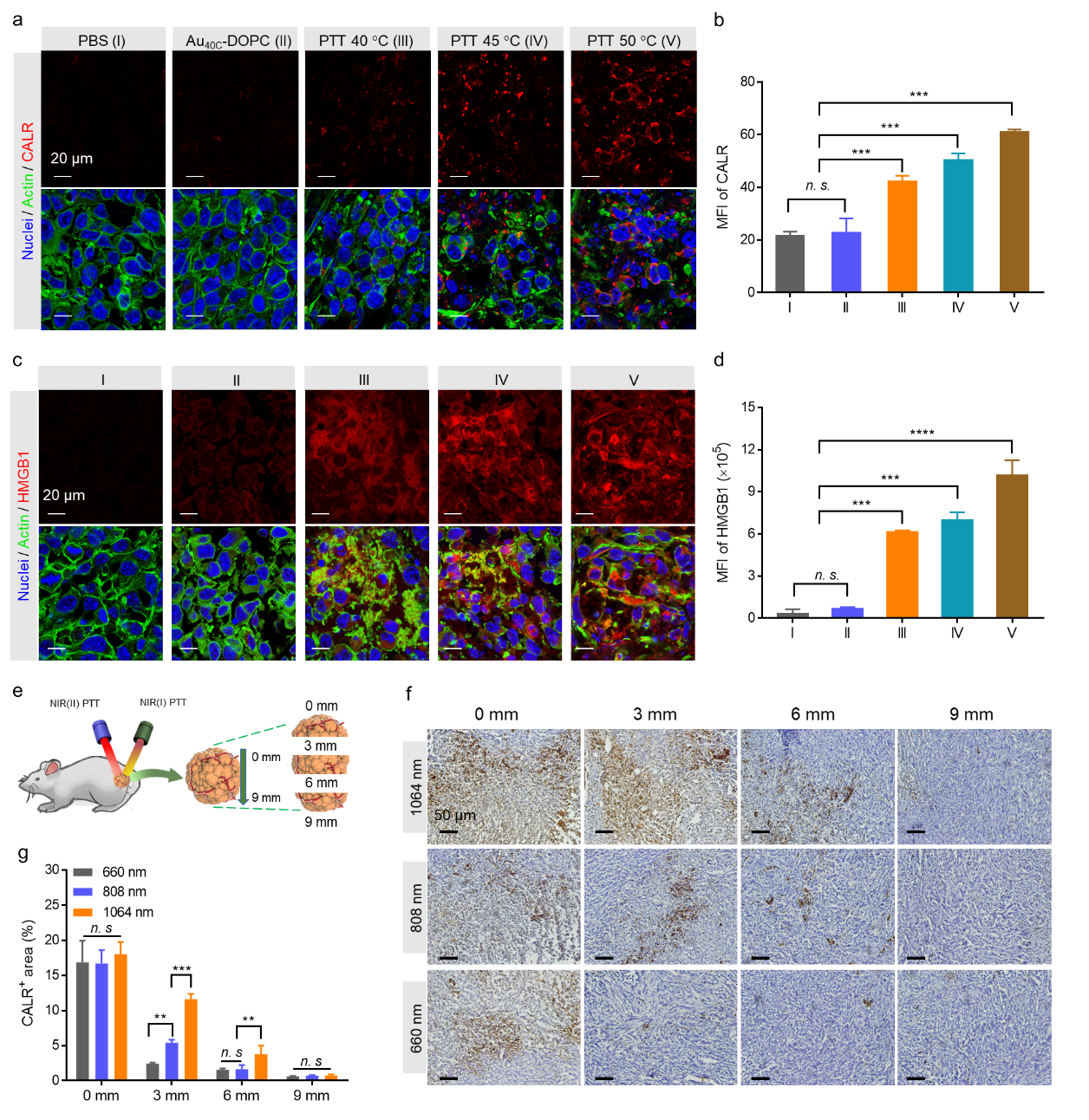
图4、NIR(II)光热诱导肿瘤深部区域中更显着的DAMPs释放
最后,基于NIR(II)光热可以引起全身抗肿瘤免疫力的增强,进一步研究了其抑制肿瘤转移的潜力。采用二硬脂酰磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)和红细胞膜修饰的超薄PPy(Em@PPy)用作NIR(II)光热的光热试剂。NIR(II)光热,Imi联合α-PD-1治疗可显着抑制肿瘤转移,并且显着减少了肿瘤结节的数量。NIR(II)介导的ICD可能是一种敏化α-PD-1检查点阻断免疫疗法的有效方法,在临床上预防肿瘤转移方面很有希望。

图5、NIR(II)光热诱导的ICD预防4T1肿瘤转移
该研究成功地证明了在实体瘤中,NIR(II)光诱导的热效应可以比NIR(I)和红光更均匀,可以在肿瘤更深层次触发免疫原性癌细胞死亡。NIR(II)光热可通过激发先天性和适应性免疫来实现有效的肿瘤控制和转移预防。此外,静脉注射的红细胞膜包裹的二维聚吡咯纳米片用作NIR(II)光热全身治疗,以实现协同的光热免疫反应并引发抗肿瘤免疫力,从而抑制全身转移肿瘤模型发挥惊人的治疗作用,最终延长小鼠的生存时间。该策略提供了一种有效的方法,可逆转肿瘤深处的免疫抑制并与免疫疗法协同作用,以改善原发性,远端性和转移性肿瘤的治疗效果。
该工作得到了国家重点研发计划(2017YFA0205200和2017YFA0205600)和国家自然科学基金(NOs. 51773191, 81571785, 和31971314)的资助。
该论文发表在ACS Nano上,论文题目为“Near-Infrared II Phototherapy Induces Deep Tissue Immunogenic Cell Death and Potentiates Cancer Immunotherapy”。中国科学技术大学王育才教授和合肥工业大学王峰教授为本文的通讯作者。
- 唐本忠院士/徐峰教授团队/郑磊教授团队合作AM:是“金子”,不仅能增强AIEgen发光,还能提升光疗 2023-07-29
- 中科院化学所肖海华研究员团队《Adv. Mater.》:可降解的近红外二区假性共轭聚合物光热剂治疗高级别浆液性卵巢癌 2021-12-01
- 中科大王育才教授/白丽教授合作Nano Letters:高分子材料增强自然杀伤性T细胞的肿瘤治疗效果 2021-07-21
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 福大林立森/新国大陈小元 Nature大子刊:当手性水凝胶遇上细胞膜仿生-可术后空腔植入的生物杂化水凝胶如何调节肿瘤干细胞信号 2025-12-30
- 苏州大学冯良珠教授、刘庄教授团队 AFM:温敏催化水凝胶助力酶触“破膜+氧化应激”级联肿瘤消融新策略 2025-12-04
- 山东大学崔基炜教授团队 AFM:复合水凝胶通过免疫调控促进骨质疏松性骨折修复 2025-11-14
