自然杀伤性T细胞(NKT细胞)表面既有T细胞受体TCR,又有NK细胞受体。它具有强大的肿瘤杀伤潜能,它一方面可以通过细胞毒活性和快速产生的细胞因子直接杀伤肿瘤,另一方面可以通过激活免疫系统的多种组分(包括NK细胞和CD8+ T细胞)间接杀伤肿瘤。另外,由于向NKT细胞提呈抗原的CD1d分子的保守性,转输的NKT细胞可以作为通用型免疫疗法,且不易引起移植物抗宿主病。鉴于NKT细胞在抗肿瘤方面的以上诸多优势,目前已开展了多个基于NKT细胞的临床试验用于治疗多种类型的实体肿瘤,如乳腺癌、黑色素瘤、肺癌、鳞状细胞癌等,显示了一定的治疗效果。尽管如此,NKT细胞的抗肿瘤活性仍受制于有限的肿瘤浸润和肿瘤免疫抑制微环境引起的细胞失能,如何发展有效策略解决以上瓶颈问题、进一步提升NKT细胞的抗肿瘤活性将是解决NKT细胞疗法临床转化的关键所在。
近日,中国科学技术大学生命科学与医学部王育才教授与白丽教授课题组合作开发了一种利用光热疗法(PTT)预处理肿瘤组织来增强过继转输的NKT细胞抗肿瘤能力的策略。FDA批准的高分子材料PEG-PLGA包载共轭聚合物PBIBDF-BT用作光敏剂(NPs@PBT),在808纳米近红外光的激发下产生热效应。PTT处理的肿瘤组织上调表达NKT细胞相关的趋化因子,有效招募转输的NKT细胞。且PTT处理引起肿瘤部位促炎性细胞因子的表达和DC的成熟,促进NKT细胞的活化。活化的NKT细胞可进一步引发级联免疫应答,增强NK和CD8+ T细胞的细胞毒活性。因此,PTT联合NKT细胞转输显示出强大的对原位肿瘤的杀伤能力,在此过程中产生的系统性免疫应答可有效抑制远端肿瘤的生长。更为重要的是,这一联合疗法可诱发免疫记忆的形成,从而避免肿瘤的转移和复发(图1)。该策略有望提高过继转输的NKT细胞的实体肿瘤治疗效果。

图1、A. NKT细胞的体外扩增。B-D. PTT联合NKT细胞转输有效抑制原位肿瘤和远端肿瘤的生长,并可抑制肿瘤转移和复发。
研究结果表明NPs@PBT可有效在肿瘤部位富集,并显示出较强的光热转换效应。PTT处理的肿瘤组织上调NKT细胞相关的趋化因子CXCL9,CXCL10,CXCL12和CCL3,相应地,其招募转输NKT细胞的能力也明显增强(图2)。以上结果说明PTT处理可以克服转输的NKT细胞在实体肿瘤中浸润能力低这一障碍。

图2、A. NPs@PBT制备流程图。B. NPs@PBT在MC38荷瘤小鼠中的分布。C. 小鼠肿瘤部位温度监测。D. PTT处理后肿瘤部位趋化因子水平。E. 监测转输NKT细胞肿瘤部位分布的流程图。F. 转输的NKT细胞在PTT处理与否的肿瘤部位的富集。G. 量化分析转输的NKT细胞在不同处理肿瘤部位的富集水平。
另外,研究者发现PTT处理可促进肿瘤中促炎细胞因子的表达和树突状细胞(DC)的招募与活化,提示PTT处理逆转了肿瘤免疫抑制微环境,为转输的NKT细胞抗肿瘤功能的发挥扫除了第二层障碍。结果显示在PTT处理的肿瘤组织中,转输的NKT细胞表达功能性分子IFN-γ的水平明显上调。且PTT活化的NKT细胞可进一步激活具有强大细胞毒功能的NK细胞和CD8+ T细胞(图3)。
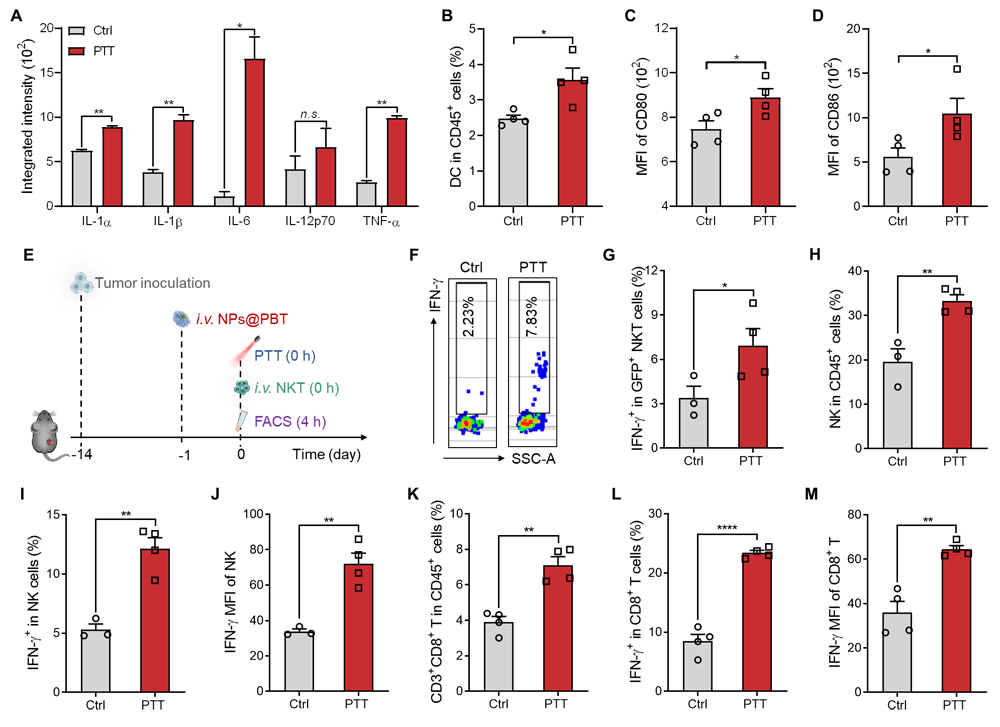
图3、A. PTT处理后肿瘤部位促炎性细胞因子水平。B. 肿瘤中DC比例。C, D. DC表达CD80和CD86的平均荧光强度。E. 研究PTT对转输的NKT功能影响的流程图。F. NKT细胞产生IFN-γ的代表性流式图。G. 转输的NKT细胞中产生IFN-γ的比例。H. NK细胞比例。I.产生IFN-γ的NK细胞的比例。J. NK细胞表达IFN-γ的平均荧光强度。K. CD8+ T细胞比例。L.产生IFN-γ的CD8+ T细胞的比例。M. CD8+ T细胞表达IFN-γ的平均荧光强度。
基于以上多种效应,PTT联合NKT细胞转输可有效抑制原位瘤生长,且其产生的系统性免疫应答可进一步抵抗远端肿瘤。在此过程中形成的免疫记忆可在较长时间内抑制肿瘤的复发和转移(图4)。
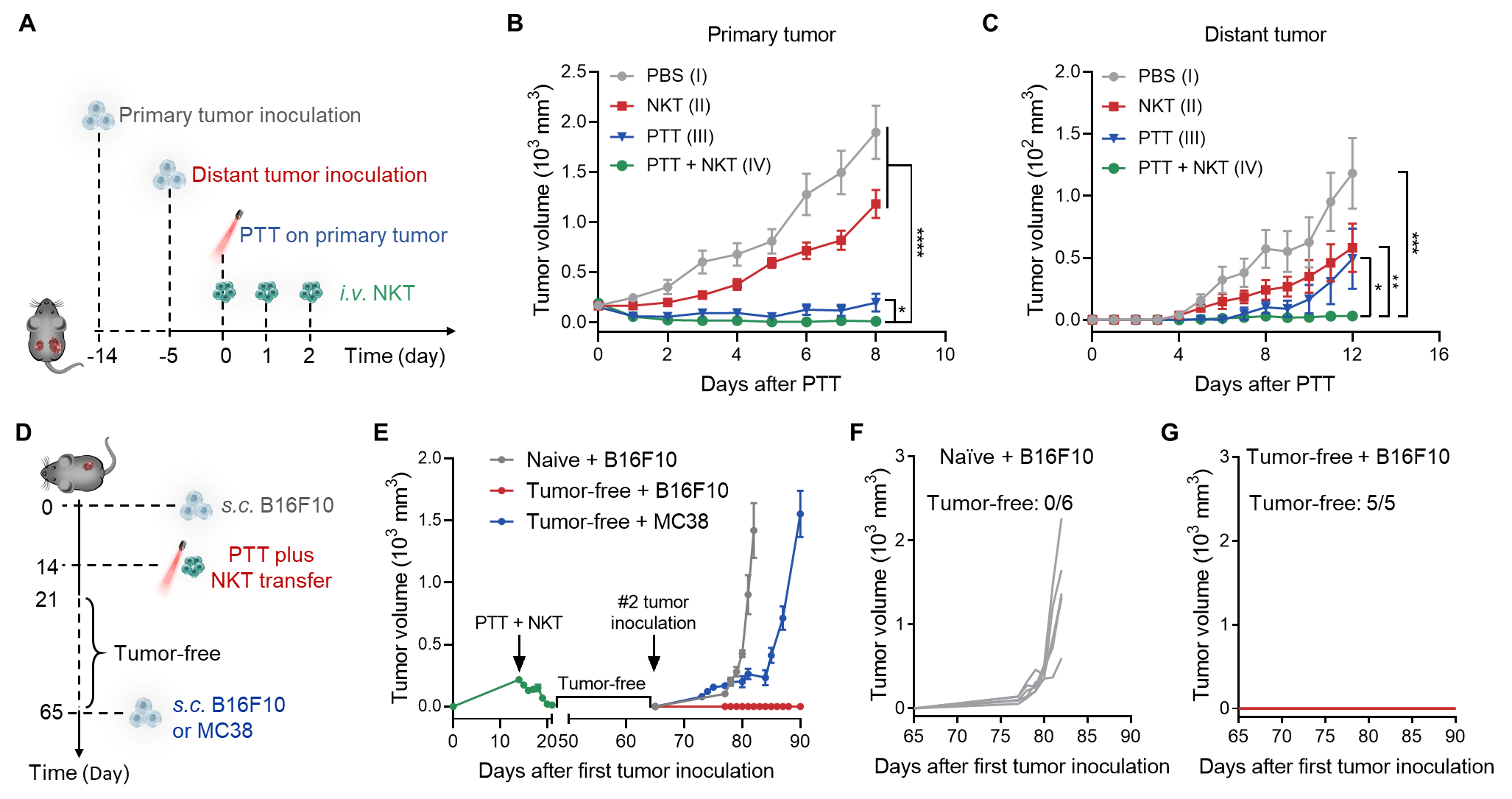
图4、A. PTT联合NKT细胞转输用于肿瘤治疗的流程图。B, C. 原位肿瘤和远端肿瘤的肿瘤生长曲线。D. 研究PTT联合NKT细胞转输抑制肿瘤复发的流程图。E-G. 肿瘤生长曲线。
该研究以Phototherapy Facilitates Tumor Recruitment and Activation of Natural Killer T cells for Potent Cancer Immunotherapy为题在Nano Letters发表。王育才教授和白丽教授为该论文的共同通讯作者,李敏博士、解迪博士和博士生唐新锋为该论文的共同第一作者。该研究工作得到了国家重点研发项目、国家自然科学基金、中央高校基本科研业务费专项基金、中国科学院合肥科学中心协同创新项目、安徽省自然科学基金和安徽省科协青年托举项目的支持
原文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.1c02238
- 唐本忠院士/徐峰教授团队/郑磊教授团队合作AM:是“金子”,不仅能增强AIEgen发光,还能提升光疗 2023-07-29
- 中科院化学所肖海华研究员团队《Adv. Mater.》:可降解的近红外二区假性共轭聚合物光热剂治疗高级别浆液性卵巢癌 2021-12-01
- 东北林业大学贾涛副教授、赵修华教授团队JMCB封面文章:“一体化”策略近红外荧光成像指导的肿瘤双模治疗 2021-07-21
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 广西师大沈星灿教授、蒋邦平教授、梁宏教授团队:二价阴离子驱动溶菌酶凝胶化的普适性策略及其免疫记忆抗糖尿病伤口感染复发 2024-09-09
