近年来,“自下而上”模块化组织工程的发展及体外构建具有特定结构和功能的微组织得到了迅速发展。但是,目前很多“自下而上”组装方法还只是一些初步的探索性研究,如果构建的三维组织中没有可以利用血管网络来输送营养和移除代谢产物,组织厚度则难以有效增大。因此,如何利用微载体在体外构建模块化内皮细胞-微纤维复合生物支架并利用其可注射性避免手术创伤进行原位再生新生血管具有重要的研究意义。
华侨大学陈爱政教授课题组和哈佛医学院Y. Shrike Zhang教授课题组以海藻酸钠(sodium alginate, SA)和明胶(gelatin, Gel)为原料,通过微流控液滴融合技术及离子交联技术相结合的方法,在内包裹人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)的海藻酸/明胶微液滴和氯化钙微液滴融合的同时,在受限空间内使液滴迅速固化成微纤维状,并利用明胶在后期不同程度的固定控制细胞的迁移和生长,在短纤维内部形成具有中空结构的细胞层,从而模拟模块化血管的结构和功能,并在体外和动物体内实验进行了初步的验证。
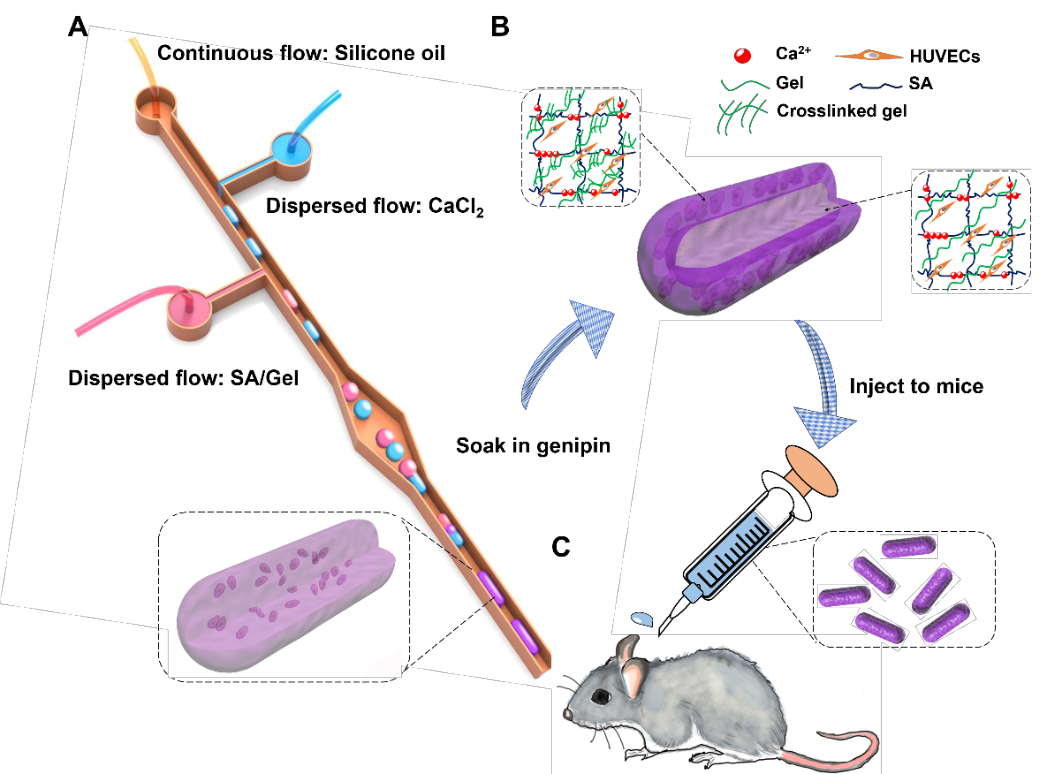
图1 研究示意图
通过微流控液滴融合技术及离子交联技术相结合的方法得到分散性好、长径比均一的海藻酸盐棒状微纤维,并通过Minitab全因子实验设计方案,考察结果表明海藻酸盐浓度、连续相分散性流速比对微纤维的长径比影响显著。另外,将明胶加入到海藻酸钠中,可提高海藻酸盐的细胞相容性,且不影响海藻酸/明胶复合微液滴与氯化钙液滴的有效融合。
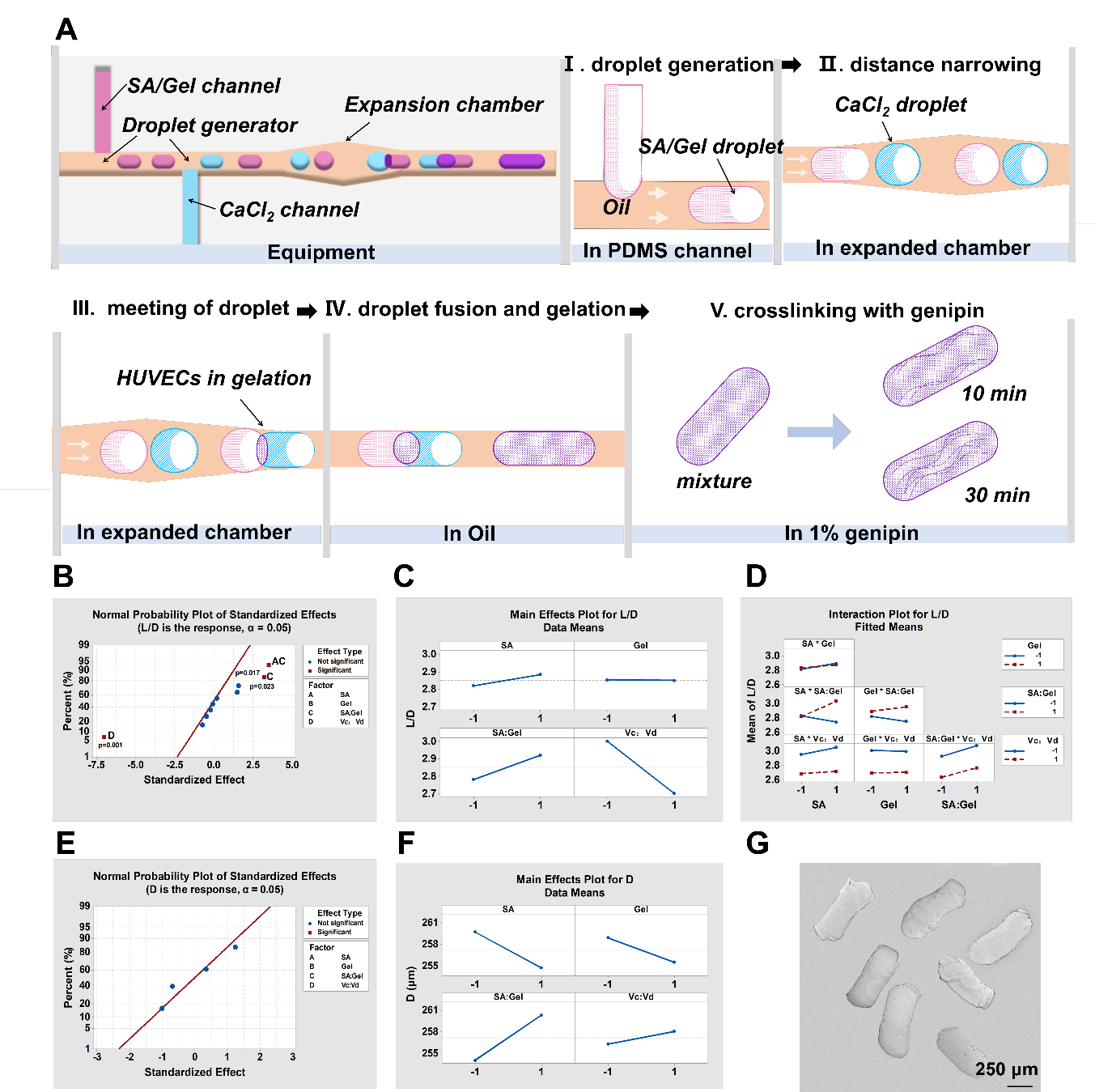
图2 (A)微纤维的制备流程示意图(B-F)Minitab全因子实验分析(G)微纤维明场图。
为进一步探究明胶对内包裹的HUVECs增殖和迁移的作用,利用京尼平(genipin)对得到的微纤维进行明胶不同程度的固定,固定时间设置为10 min、30 min,同时设置不固定明胶组作为对照组。结果发现,在固定时间为10 min时,微纤维外部产生了更有利于细胞增殖的微环境,而微纤维内部的明胶由于没有得到有效固定,导致内部的细胞逐渐开始向外迁移。最终在HUVECs在微纤维内部共培养21天后,形成了中空结构的细胞层。HE体外支架染色对结果进行了进一步的验证。

图3. (A)支架中HUVECs共培养21天后CD31及VE-Cad蛋白表达情况(B)3D扫描支架观察细胞分布(C)对微纤维进行免疫组化染色(D)支架中细胞基因表达情况分析。
为进一步实验该微纤维与体内组织的相互作用,将内包裹HUVECs的微纤维体外培养21天后,通过皮下注射到SCID小鼠耳后组织,研究其在小鼠体内的相互作用,设置未负载HUVECs的空白微纤维支架为对照组。可以观察到,相比于空白支架组,实验组引起了更多的巨噬细胞的聚集,并在注射后21天时,支架周围产生小血管。

图4.(A)将微纤维注射入体内后HE染色及(B)CD31免疫组化染色。
以上相关成果以“Endothelialized Microrods for Minimally Invasive in situ Neovascularization”为题近期在线发表于Biofabrication。论文第一作者为华侨大学生物材料与组织工程研究所17级博士生王颖。通讯作者为哈佛医学院Y. Shrike Zhang教授和华侨大学陈爱政教授。华侨大学2016级硕士研究生胡璇、Ranjith Kumar Kankala博士、王士斌教授和福建医科大学杨达云博士、复旦大学中山医院朱铠博士为论文的共同作者。
华侨大学部分的研究工作得到国家自然科学基金海峡联合重点项目《可注射型复合生物支架介导血管化肌组织原位再生的研究》(U1605225)及福建省生物材料科技创新团队项目的资助。
论文链接:https://iopscience.iop.org/article/10.1088/1758-5090/ab47eb
- 西安交大李涤尘/贺健康团队 Adv. Mater.:3D打印微纤维支架引导高密度定向心肌组织构建 2025-01-17
- 东华大学熊佳庆课题组 Adv. Mater.:微纤维两栖软体机器人实现电磁辐射动态感知 2024-09-30
- 天津工业大学王润、刘雍/南开大学刘遵峰《Adv. Sci.》:基于氢键纳米团簇的仿蛛丝水凝胶微纤维 2024-04-21
- 南林黄超伯、宁波材料所陈涛《Adv. Mater.》:生物启发的具有可调螺旋结构的异质球体 → 用于准确有效地控制血糖水平 2025-06-18
- 湘潭大学王秀锋教授 Lab Chip:基于热反馈实现个性化水合管理的皮肤可贴合微流控技术 2024-11-02
- 湘潭大学王秀锋/宾州州立程寰宇 Adv Sci:用于汗液定量分析的皮肤可贴合双流体纸基微流控技术 2024-02-04
