癌症是严重危害人类健康的重大疾病之一,化疗药物在癌症治疗中发挥着重要作用。然而,这些小分子化疗药物具有严重的毒副作用,主要源于其无差别的体内分布及肿瘤细胞多药耐药性的发生发展。如铂类抗肿瘤药物(顺铂、奥沙利铂等),在临床上长期广泛应用的过程中,逐渐产生严重的耐药性问题,包括细胞摄取降低,外排增加,胞内GSH解毒以及增强受损DNA的修复等。为了解决该问题,设计发展了多种铂类纳米药物(如大分子类铂复合物,脂质体,胶束,介孔硅,二维材料),增强肿瘤细胞摄取,抑制GSH解毒功能,在一定程度上可抑制铂耐药性发展。然而由于铂的外排通路未受到抑制,这些铂类纳米药物并未彻底逆转肿瘤耐药,其抗肿瘤效果仍有很大地提高空间。钯与铂具有相似的外层电子结构和配位化学性质,表现出治疗铂耐受肿瘤的潜在效力。然而钯类配合物体内水解迅速、静脉注射的无差别递送、高亲水性导致肿瘤部位滞留能力差。这些都严重限制了钯类化合物在肿瘤治疗,特别是对于铂耐药肿瘤治疗的应用。
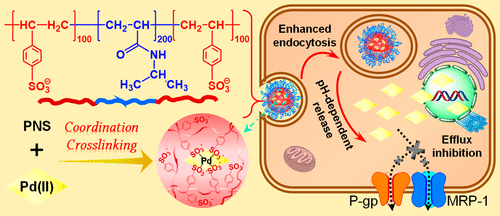
为了解决该问题,杨祥良教授和赵彦兵教授的课题组通过原子转移自由基聚合设计了一种三嵌段温敏聚合物(聚苯乙烯磺酸钠-聚N-异丙基丙烯酰胺-聚苯乙烯磺酸钠),并与四氯钯酸钾(K2PdCl4)自组装形成钯离子(Pd(II))配位交联的温敏纳米凝胶(Pd-PNS)。Pd-PNS具有高达40%的Pd(II)负载量,且实现了肿瘤酸性微环境调控的Pd(II)缓控释药特征。而且,Pd-PNS具有优异的温敏溶胶-凝胶相转变行为,可用于局部瘤内注射给药。通过在肿瘤局部的原位凝胶化,实现了高度亲水Pd(II)在肿瘤部位的长效滞留。组织分布实验表明注射14天后,与游离组仅存11.1%相比, Pd-PNS纳米凝胶组仍有高达49.7%的Pd(II)滞留在小鼠肿瘤内。因此,Pd-PNS纳米凝胶可有效发挥Pd(II)增强摄取、抑制胞内外排等逆转铂耐药能力。DNA断裂损伤,肿瘤干细胞杀伤以及荷瘤裸鼠抑瘤等实验都证实了与游离Pd(II)和相应的载顺铂PNS纳米凝胶相比,Pd-PNS纳米凝胶对于铂耐受肿瘤具有更为优异的治疗效果。
该工作为治疗顺铂耐受肿瘤提供了一种新思路,为Pd(II)化合物瘤内长效滞留提供了一种新策略。
以上成果发表在Chemistry of Materials (Chem. Mater. 2019, DOI: 10.1021/acs.chemmater. 9b00986)上。华中科技大学生命科学与技术学院在读博士生赵浩与2014级本科生毕业生徐家宝为该论文的共同第一作者。生命科学与技术学院黄文晶博士参与了该项研究。该研究得到国家重点研究计划(2018YFA0208903)和国家自然科学基金(81673016, 81773653)的资助。
- 浙理工钟齐教授团队《Adv. Opt. Mater.》:受唐代装饰纹样启发的复合纳米凝胶基可涂绘型纹身贴用于紫外线辐照监测 2023-01-07
- 北化尹梅贞教授团队《Nano Today》:双重增敏的苝酰亚胺基纳米光诊疗剂用于肿瘤温和光治疗 2022-03-22
- 华南理工大学贾永光《Chem. Eng. J.》综述:具有最高临界溶液温度的聚合物药物载体及其应用 2022-01-10
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 华科大李子福教授 Nat. Commun.:相变纳米凝胶赋能生物医学新突破 2025-12-22
- 山东大学栾玉霞教授团队 Nat. Nanotech.:发现解决CAR-T细胞疗法实体瘤疗效受限的有效方法 2025-05-20
