纳米递药系统作为癌症化疗药物递送的一种重要方式得到研究者的广泛关注。然而一些纳米递药系统的载药量较低,需要提高载体的浓度达到给药水平,但却给机体带来额外的毒性。同时一些药物的非特异性释放也会给正常组织带来毒性。刺激响应性释药是纳米递药系统常用的一种递药策略,它能确保纳米递药系统在特定的位置释放药物,从而提高疗效、减少毒副作用。但该策略仍然难以避免一些未被有效包封的药物在血液中的释放。如何有效的提高纳米药物的载药量同时提高释药的特异性仍是一个挑战。
针对上述问题,四川大学高会乐教授课题组利用二聚体提高载药量的策略设计了具有肿瘤微环境双重响应的纳米递药系统。如图1所示,制备了具有ROS响应的两亲性二嵌段分子胆红素-PEG载体和具有GSH响应的二硫键连接的二聚体(d-SN38和d-LND)前药,通过胆红素与二聚体药物的疏水相互作用,构建了具有肿瘤微环境双重响应的胆红素-PEG前药纳米粒(SL@BRNPs)。同时,联合使用主动靶向肽iRGD和免疫检查点抑制剂PD-L1抗体,以达到免疫治疗与化疗联合抗肿瘤的效果。
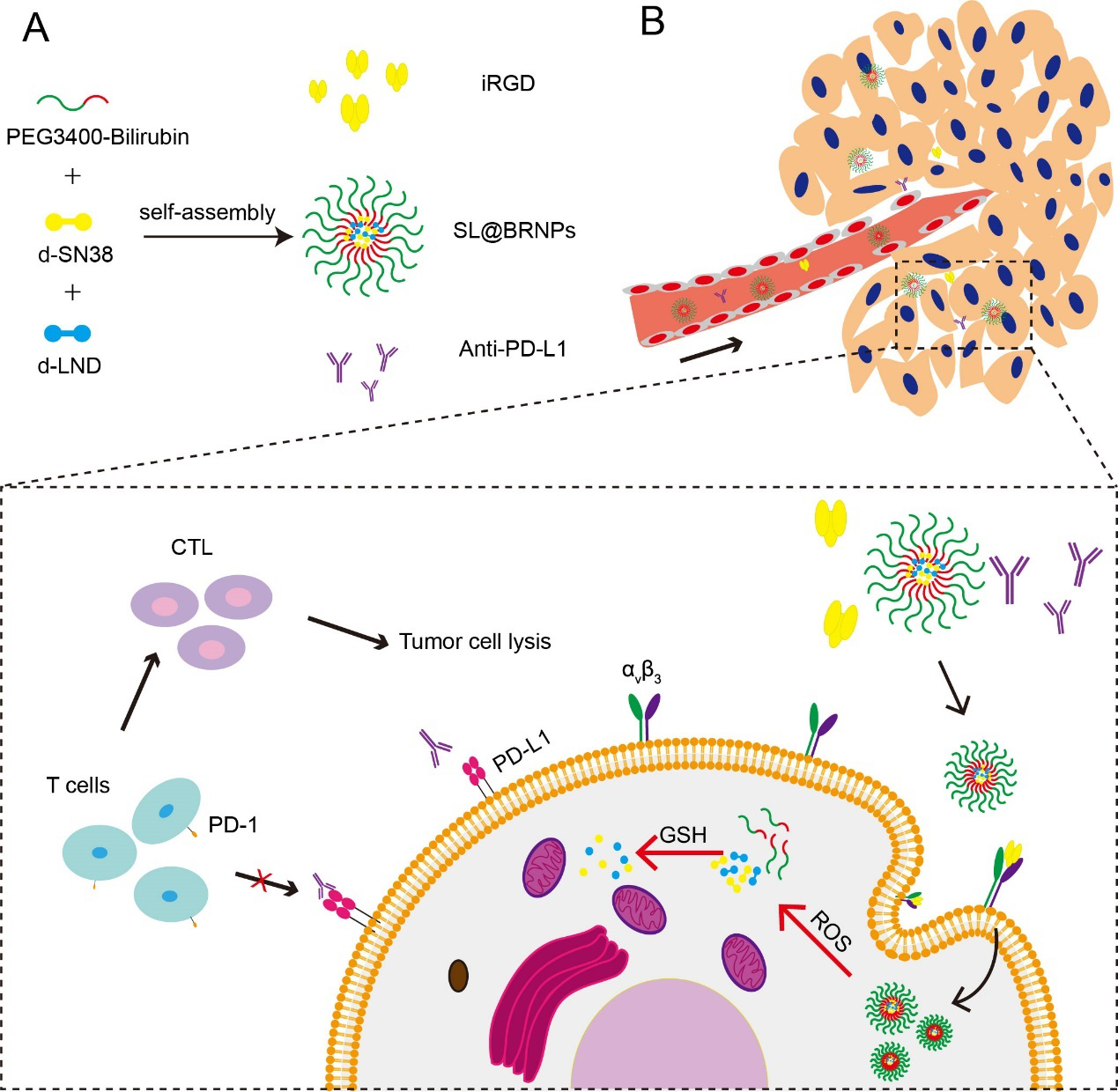
图1 胆红素-PEG自组装形成纳米粒包裹二聚体药物(d-SN38和d-LND)构建肿瘤微环境双重响应纳米粒(SL@BRNPs),合用iRGD促进纳米粒在肿瘤部位的蓄积,并联合PD-L1抗体进行免疫治疗。
研究结果表明,SL@BRNPs具有良好的ROS响应性,可以在过氧化氢的刺激下特异性的释放二聚体前药,而二聚体前药可以进一步响应肿瘤微环境中的GSH,断裂形成有活性的药物单体。双重刺激响应性的特性可以极大降低由药物泄漏产生的不良反应。同时二聚体的应用极大的提高了纳米粒的载药量。此外,iRGD的应用赋予纳米粒主动靶向的效果,提高纳米粒在肿瘤部位的蓄积;而PD-L1抗体的应用则阻断了体内的抗肿瘤免疫抑制微环境,提高杀伤原位肿瘤细胞的能力并产生长效的抗肿瘤转移的效果。该递药系统可以有效提高纳米系统的载药量并降低药源性毒性,同时联合免疫进一步提高化疗产生抗肿瘤效果,对肿瘤治疗具有重要意义。
相关研究成果近期发表在Advanced Functional Materials上(Adv. Funct. Mater. DOI: 10.1002/adfm.201901896)。该工作得到了国家自然科学基金和中国科协青年人才托举工程等的资助。文章的第一作者是四川大学华西药学院17级硕士生杨小童,通讯作者是高会乐教授。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.201901896
- 苏大李刚、附一院李峰和附四院沈罡 IJBM: 兼具抗菌和抗狭窄功能的载药可降解输尿管支架 2025-06-29
- 上海交大庞燕团队 Sci. Adv.:原位“两面神”载药涂层 可实现持久舒适的眼表给药 2025-03-13
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 南林蔡旭敏/王石发、港中深唐本忠、浙大张鉴予 Chem. Sci.:从天然电子受体到极性/多晶型响应的BioAIE智能防伪材料 2025-12-17
- 苏州大学汪晓巧教授《Nat. Commun.》:仿生蛛丝再突破!湿纺技术制备高性能水凝胶纤维 - 兼具高强韧性与智能响应性 2025-12-03
- 华东理工刘润辉教授课题组 JACS:双胍基化聚噁唑啉-胰岛素复合物在小型猪中实现长效葡萄糖响应性胰岛素释放 2025-10-25
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
