北京化工大学刘惠玉教授与中科院生物物理研究所阎锡蕴院士、范克龙副研究员等合作首次开发了一种具有单原子分散活性中心的纳米酶(简称为“单原子纳米酶”)用于抗菌及促伤口愈合应用。相关成果发表在《Angewandte Chemie International Edition》,DOI:10.1002/anie.201813994。论文第一作者为北京化工大学徐柏龙同学、王伟伟博士及国家纳米中心王会副研究员,通讯作者为刘惠玉教授、阎锡蕴院士及范克龙副研究员。
自2007年Fe3O4纳米颗粒被首次报道具有过氧化物酶活性以来,具有类酶活性的纳米材料,即纳米酶,得到了广泛的关注和深入的研究。然而,迄今大部分纳米酶的发现都是基于纳米材料类酶活性的发现,再到活性验证和评估的过程,很少能够定向地从结构上模拟天然酶,这个现状阻碍了对纳米酶结构-活性的深入研究。如何精准控制纳米酶的生物催化活性位点以研究纳米酶的结构-活性关系是揭示其催化机理和拓展其生物应用的关键。
近年来,单原子催化剂(SACs)由于其高的原子利用率、优异的选择性和催化活性,在多相催化领域引起了人们的广泛关注,然而SACs在纳米酶领域却鲜有报道。SACs具有原子分散的金属活性中心,为他们可控制备具有单一催化活性位点的纳米酶并揭示其酶学催化机理提供了突破口。
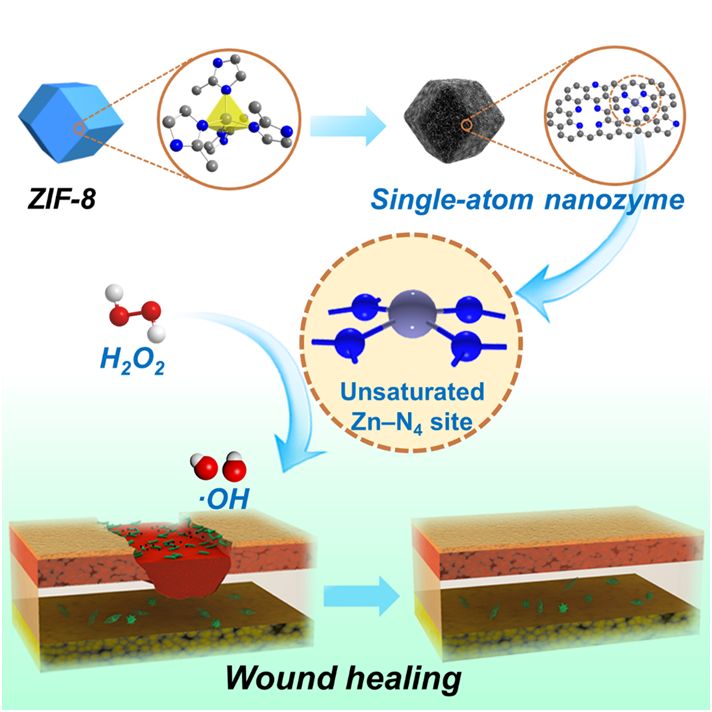
图1. ZIF-8衍生的单原子纳米酶用于伤口抗菌示意图
基于此,他们首次发现一种金属有机框架材料ZIF-8衍生的Zn?N?C SACs可作为一种理想的单原子纳米酶(PMCS),这种新型的单原子纳米酶具备如下特点:
-
1)具有单一、分散均匀的金属锌活性位点,表现出和天然酶类似的M?Nx活性中心,有利于揭示纳米酶的结构-活性关系及催化机理;
-
2)拥有优异的类过氧化物酶活性和体内外抗菌活性,能够显著促进伤口的愈合;
-
3)具有的Zn?N4不饱和位点是高效发挥类酶活性的关键因素,可有效促进过氧化氢的分解和羟基自由基的生成。
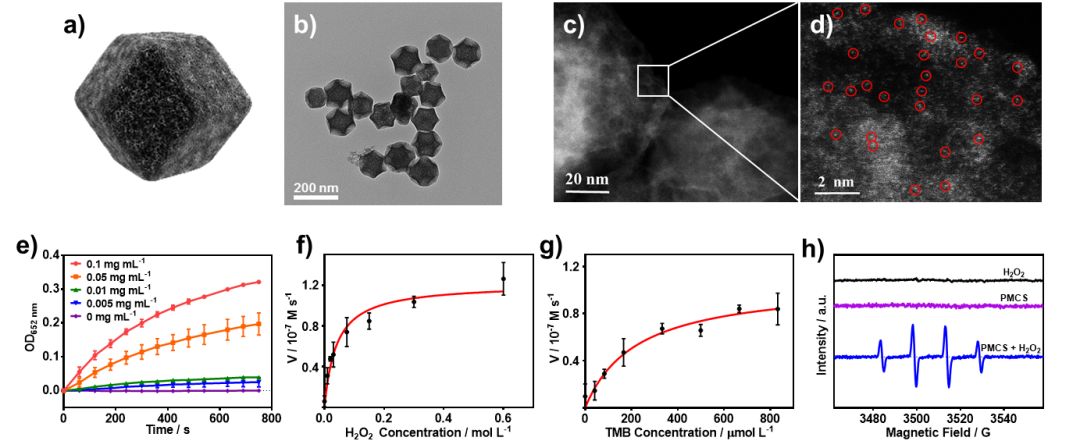
图2. 材料TEM图及类酶活性表征
材料制备及类酶活性表征
要点:利用ZIF-8在800 °C高温下碳化,构建得到单原子锌催化剂,并证实其可作为一种单原子纳米酶,具有高效的过氧化物酶活性,对H2O2和TMB底物表现出高的亲和力。此外,通过ESR实验证实该单原子纳米酶能够有效地促进H2O2的分解,产生大量的羟基自由基。

图3. XPS、EXAFS表征及密度泛函数理论计算研究
结构演化及催化机理研究
要点:通过制备一系列不同碳化温度下得到的ZIF-8衍生的碳材料作为对比,研究ZIF-8在高温过程中的结构演变,结果发现,800 °C下得到的PMCS单原子纳米酶具有最多单原子锌活性位点及最高的催化活性。证实单原子锌位点的存在是高催化活性的来源。利用密度泛函数理论(DFT)计算,揭示其活性结构为不饱和的Zn?N4结构,同时提出该单原子纳米酶促进H2O2均裂产生羟基自由基的可能途径。
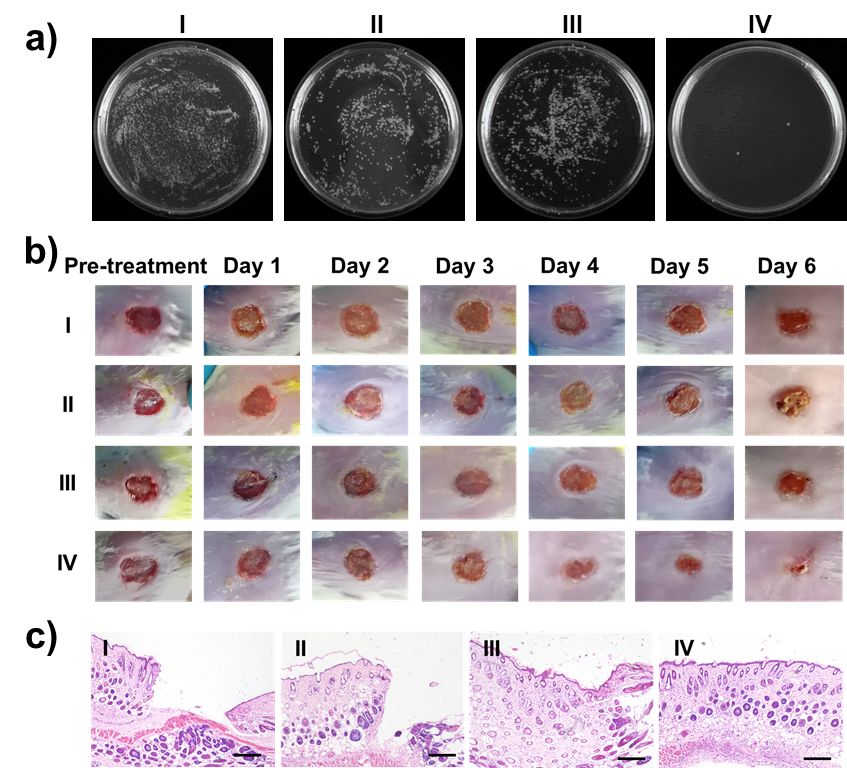
图4. 体内外抗菌性能评估
体内外抗菌性能研究
要点:这种制备得到的单原子纳米酶在体外抗菌抗菌实验中,表现出高达99.85%的抑菌率。在小鼠伤口模型实验中,能够在低浓度H2O2情况下有效促进伤口的愈合,并且具有很高的生物安全性。
在该研究中,作者利用广泛研究的ZIF-8为前驱体,通过介孔硅保护策略,构建了具有单原子锌分散的单原子纳米酶。通过Raman、XPS等手段,研究其ZIF-8在高温碳化过程中的结构演化行为。并结合密度泛函数理论计算,揭示了所构建的单原子纳米酶的不饱和活性结构及可能的催化机理。因此,他们相信该工作能够有助于理解纳米酶的催化机理,并促进SACs在生物催化领域的发展。
本工作感谢扬州大学高利增教授、中科院高能物理所郑黎荣副研究员、国立台北科技大学陈生明教授、国家纳米中心施兴华研究员及北京化工大学庄仲滨教授提供的支持与帮助。
刘惠玉教授,北京化工大学博士生导师,国家优秀青年科学基金获得者。课题组长期致力于纳米生物材料制备基础与结构调控,抗癌诊治等健康工程应用,研究成果相继刊发在Adv. Mater., 2018, 30, 1800180, Adv. Mater., 2017, 1700448, Adv. Mater., 2016, 28, 8379-8387, Adv. Mater., 2012, 24, 755-761, Adv. Sci., 2019, DOI: 10.1002/advs.201801507, Adv. Sci., 2017, 4, 1600248, Adv. Funct. Mater., 2016, 26, 4252–4261, ACS Nano, 2018, 12, 9022-9032, ACS Nano 2015, 9, 1788-1800, Angew. Chem. Int. Ed., 2011, 50, 891-895等期刊上,为相关领域的发展提供了理论和技术指导。刘惠玉课题组网页:http://www.liuhuiyugroup.com
阎锡蕴院士,中科院生物物理所研究员、中科院院士。曾任亚洲生物物理联合会(ABA)主席。
-
1993年,在德国海德堡大学医学院获得博士学位;
-
随后,进入美国Memorial Sloan-Kettering癌症研究中心,从事博士后研究随后研究;
-
1997年,入选中科院“百人计划”,进入微生物所工作;
-
2002年-至今,调入生物物理所。
主要从事肿瘤生物学与纳米生物学研究,发现肿瘤新靶点CD146,研究其作用机制,发展针对CD146新靶点的抗体治疗策略,并转化。发现纳米酶,提出纳米酶新概念,并将其标准化。结合肿瘤生物学研究和纳米生物学研究推动应用创新:设计双功能纳米酶检测探针,创造出全球首例纳米酶产品,发展纳米酶治疗肿瘤新策略。曾获国家自然科学奖二等奖(2012)、Atlas奖(2015)、全国创新争先奖(2017)、谈家桢生命科学成就奖(2018)。
范克龙副研究员,2014年于中国科学院生物物理所获得博士学位。入选中国科协首批“青年人才托举工程”,中国科学院青年创新促进会会员。长期研究铁蛋白/纳米酶新功能及其生物医学应用。首次发现铁蛋白识别肿瘤,并据此设计纳米酶探针分子,用于肿瘤的诊断(Nat. Nanotechnol., 2012)和治疗 (PNAS, 2014; ACS Nano, 2018)。为此,应邀出席2015年美国Gordon Conference,国际同行称其为纳米领域代表性的创新理念。根据天然酶的结构特性,提出了一种仿生优化纳米酶的新策略(Chem Commun., 2017),发展了一种快速、灵敏、简便检测的纳米酶试纸条新方法(Biosensor Bioelectron, 2015),实现成果转化,获2015年度Atlas国际奖。在此基础上,设计了一种具有四种酶活性的碳氮纳米酶,利用铁蛋白的肿瘤靶向性及溶酶体亚定位,实现了体内对纳米酶的精准递送和酶活调控,建立了纳米酶催化治疗肿瘤新策略 (Nature Communications, 2018)。最新发展了一种纳米酶催化光声成像新方法(Nano Letters, 2018)。相关研究成果入选“中国十大科学进展”(2012年),获中国科学院院长特别奖(2013),中国科学院优秀博士毕业论文(2015)等奖项。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.201813994
- 天工大高辉/余云健团队 ACS Nano:创新纳米酶精准消除肿瘤胞内菌 助力结直肠癌免疫治疗突破 2026-02-20
- 杭师大黄又举教授团队 AFM:超强H2O2亲和力的体外医疗诊断试剂盒 2025-09-08
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 东华大学朱美芳教授、贾超副研究员等 AFM:抗菌、制冷多功能聚乙烯纤维防护材料 2026-01-06
- 华东理工刘润辉教授课题组 Nat. Commun.:双胍化多肽模拟物抗多药耐药ESKAPE与脑膜炎 2025-12-12
- 浙大张庆华教授团队 AFM:定制化多功能Janus织物 - 实现透气、抗菌与舒适个人热湿管理 2025-11-19
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
