天然血管、天然组织、体外诱导自体细胞产生的血管和皮下埋植产生的生物管经脱细胞化后制备的小口径人工血管(内径小于6毫米)能够很好地保留其原有的细胞外基质(ECM)的结构和功能性组分,展示了优异的通畅性、良好的血管再生性和优异的宿主-移植物整合性。然而,现有ECM的制备方法存在供体来源受限、材料加工繁琐、生物反应器要求高、体外血管培养时间长和成本高等缺点,限制了其临床应用。因此,快速低成本的构建类ECM材料有望提高小口径人工血管的临床适用性。

图1 具有类ECM的结构和功能的ES-C/Rm-G-ht的快速构建及其促血管再生
(1)ES-C/Rm-G-ht展示了类ECM的结构
ECM具有丰富的胶原纤维、层状蜂窝状结构和多种功能分子,展示了优异的强度和细胞响应性。ECM中的胶原蛋白分子可以通过非共价相互作用自组装形成水凝胶。尽管胶原蛋白水凝胶的组成和多孔结构与天然ECM相似,但它们的强度低,稳定性差,不适合用于构建小口径人工血管。
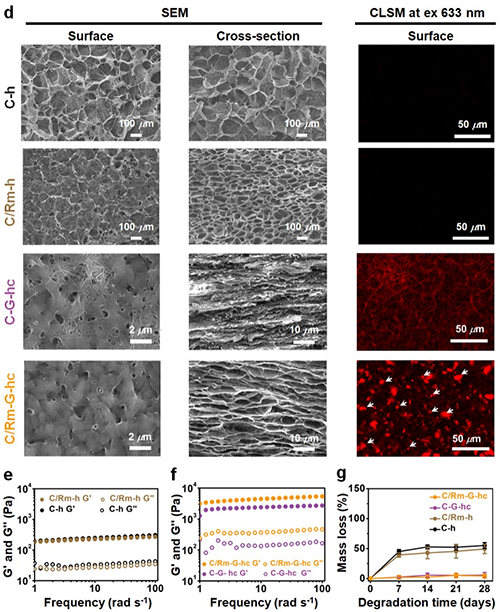
图2 胶原蛋白/红细胞膜水凝胶的微观形貌和稳定性
(2)ES-C/Rm-G-ht实现了快速构建
卷曲成型技术可以用于快速构建小口径人工血管,然而胶原蛋白/红细胞膜水凝胶管的卷曲层间粘附力不足使得制备的胶原蛋白/红细胞膜水凝胶管存在强度低和动态稳定性差等缺点(图3b)。
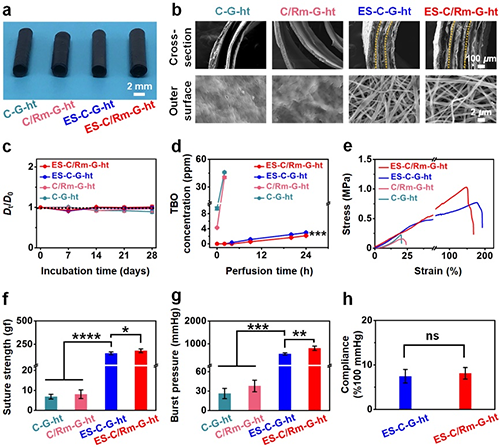
图3 ES-C/Rm-G-ht的结构稳定性和力学性能
(3)ES-C/Rm-G-ht展示了类ECM的生物活性
ES-C/Rm-G-ht的多孔结构和红细胞膜的多种功能性组分使得其具有优异的生物活性。
体外细胞实验显示C/Rm-G-hc作为ES-C/Rm-G-ht中与细胞直接的接触层,其与HUVECs共孵育48 h后,HUVECs具有高的伤口愈合率和高的细胞活性,促进了VEGF的分泌(图4a-4e)。
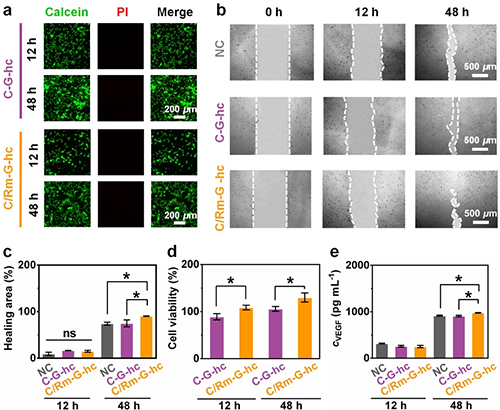
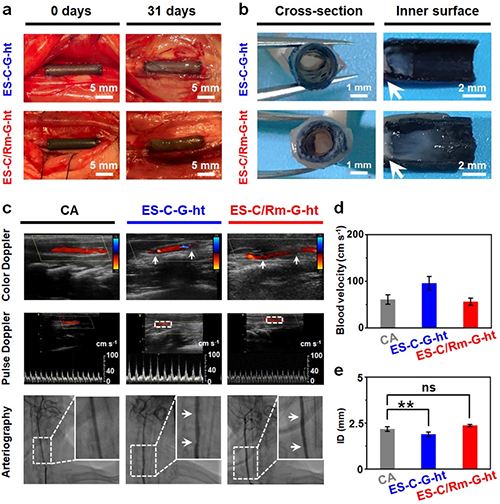
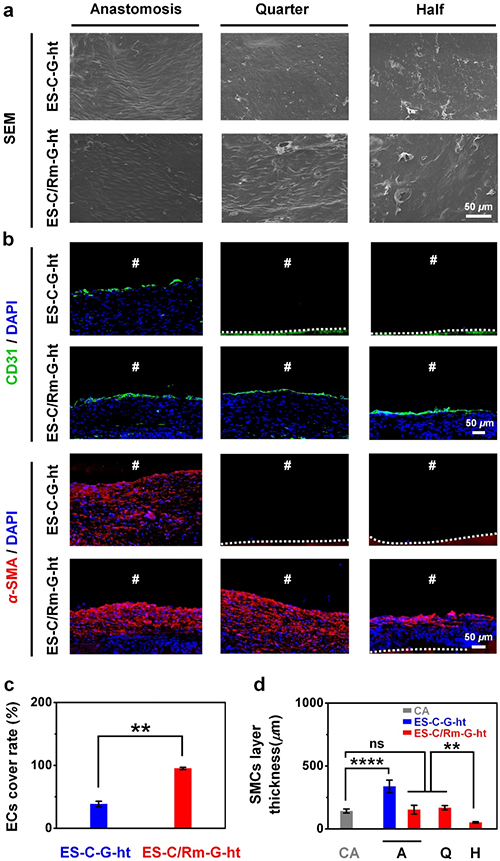
图6 ES-C/Rm-G-ht兔子颈动脉移植31天后的血管细胞的招募评价
本研究不仅提供了一种快速构建具有类ECM的结构和功能的小口径人工血管的策略,而且也为快速构建ECM仿生物或胶原蛋白衍生的组织工程支架提供了思路。
论文链接:https://doi.org/10.1021/acsnano.4c11919
- 齐鲁工大/山东省科学院王振教授团队 AFM:利用“自下而上”策略合成类细胞壁结构的抗膨胀水凝胶用于渗透能收集 2025-03-27
- 天津大学仰大勇课题组《Angew. Chem. Int. Ed. 》:通过DNA动态组装在细胞内构建类细胞器结构 2020-08-08
- 中国科大公泽/姜洪源教授团队《Commun. Phys.》:揭示了钙离子跨膜运输增强癌细胞伪足振荡生长 2025-08-28
- 华南理工大学边黎明教授团队Nature Chemistry:可模拟细胞外基质液液相分离介导的组装及生物物理特征的简约模型 2025-06-10
- 上科大郑宜君教授课题组 Nat. Commun.: 构建具有可见光响应的时空动态粘弹性水凝胶用于探究癌细胞与细胞外基质相互作用 2025-02-07
- 浙江大学彭丽华/吴琛团队 AFM:无线智能热电凝胶协同工程化人参外泌体重构仿生电场与血管再生信号加速难愈性溃疡愈合 2025-03-03
- 中科院上海硅酸盐所刘宣勇团队 Mater. Today:基于压电增强动电效应的超声响应水凝胶促进神经血管再生加速糖尿病创面愈合 2025-02-24
