澳门大学王瑞兵团队 JACS: 乏氧诱导的超分子自由基实现胞内聚合介导的肿瘤精准治疗
2025-01-15 来源:高分子科技
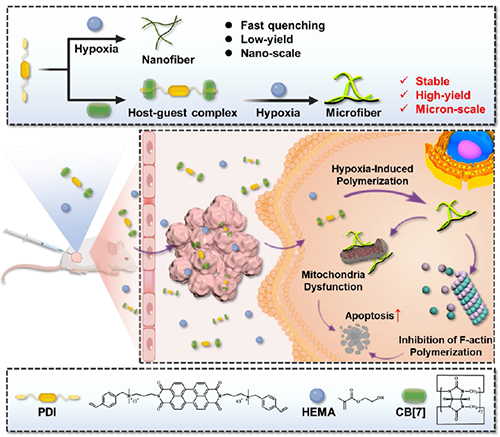
图1:肿瘤乏氧微环境中超分子自由基阴离子诱导的胞内聚合示意图。
近期,澳门大学王瑞兵团队提出了一种乏氧引发的超分子自由基体系,能够诱导胞内聚合反应,从而破坏肿瘤细胞的细胞骨架和细胞器的生理功能(图1)。该工作利用葫芦[7]脲(CB[7])和苝二酰亚胺衍生物(PDI)形成2:1超分子主客体复合物,称为PDI+2CB[7],该复合物可响应肿瘤乏氧和还原微环境,产生离域自由基阴离子。同时,CB[7]有效地增强了这些阴离子的结构稳定性,使PDI+2CB[7]复合物能够在肿瘤细胞内诱导甲基丙烯酸2-羟乙酯(HEMA)发生高效自由基聚合反应(图2)。该体系可选择性地在乏氧肿瘤细胞中发生聚合反应,引起严重的细胞毒性(图3),诱导ROS过表达和线粒体功能障碍,从而导致细胞凋亡和细胞周期阻滞(图4),改变肌动蛋白的有序分布,导致细胞骨架损伤(图5)。动物实验结果证明乏氧引发的细胞内聚合具有高效抗肿瘤作用(图6&图7)。 这项研究开发了一种胞内聚合诱导的抗肿瘤疗法,而非传统化疗药物治疗方式,具有高选择性和强效抗肿瘤作用。该工作以“Hypoxia-Initiated Supramolecular Free Radicals Induce Intracellular Polymerization for Precision Tumor Therapy”为题发表在《J Am Chem Soc》上(doi:org/10.1021/jacs.4c14847)。文章第一作者是澳门大学博士生唐冕同学,共同通讯作者是课题组前成员高成博士(现任职于深圳大学医学院)。合作者包括清华大学的徐江飞教授和法国科学院的Bardelang教授。该研究得到国家自然科学基金委、澳门科技发展基金、澳门大学、以及太湖创新计划的支持。
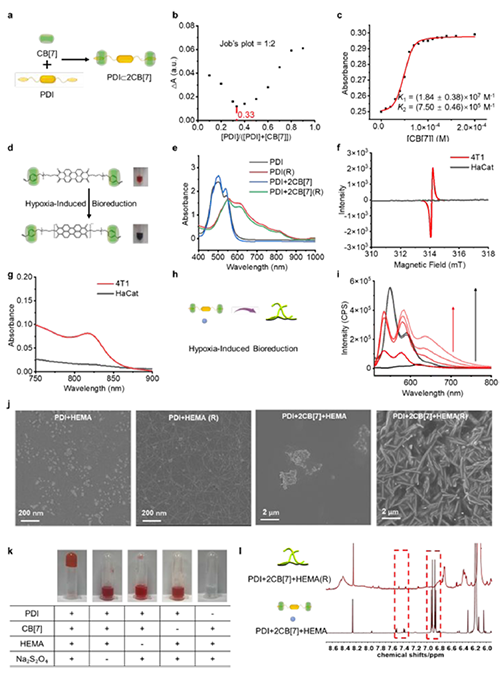
图2: PDI+2CB[7]主客体复合物的形成和超分子自由基引发的聚合反应。
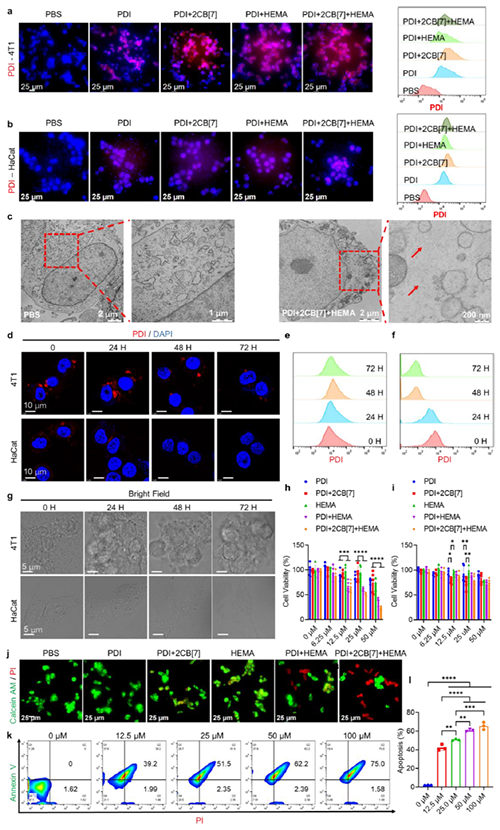
图3: 肿瘤细胞内聚合反应引发细胞毒性。
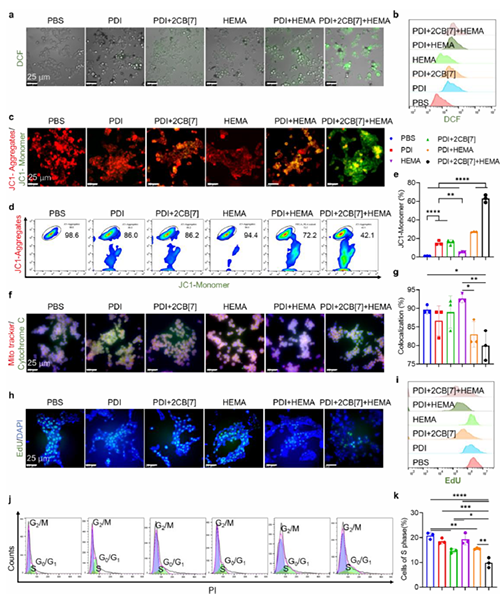
图4: 肿瘤细胞内聚合反应对细胞功能的影响。
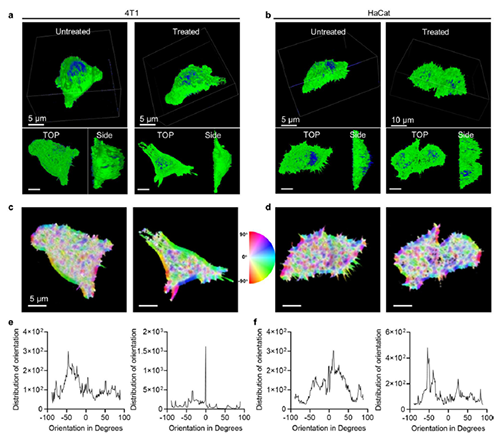
图5: 肿瘤细胞内聚合反应对肌动蛋白细胞骨架的影响。
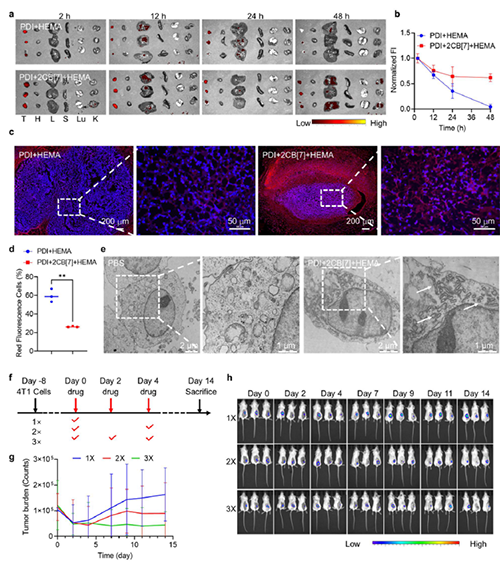
图6: 活体肿瘤细胞内选择性胞内聚合反应。
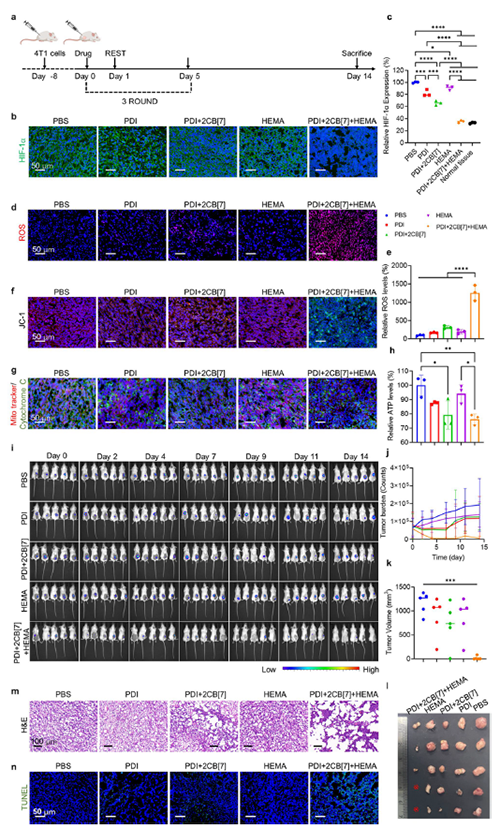
图7:活体胞内聚合反应对肿瘤的治疗作用。
原文链接:https://doi.org/10.1021/jacs.4c14847
版权与免责声明:本网页的内容由中国聚合物网收集互联网上发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:info@polymer.cn。未经本网同意不得全文转载、摘编或利用其它方式使用上述作品。
(责任编辑:xu)
相关新闻
- 华东师范大学化学与分子工程学院超分子化学团队博士后招聘启事 2021-09-14
- 清华大学张希教授课题组发现基于超分子自由基的选择性抗菌光热新材料 2017-12-21
- 华南理工朱伟、南科大余沛源、南洋理工赵彦利 Nat. Commun.:纳米隔室限域效应介导生物体内聚合反应 2023-08-30
- 国家纳米科学中心王浩研究员课题组:“活体自组装”生物纳米材料研究获进展 2017-11-09
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
