近日,国家纳米科学中心王浩课题组李莉莉副研究员和乔圣林博士通过发展“活体自组装”技术,在细胞内成功构建了不同拓扑结构的纳米材料,并提出了全新的细胞内原位聚合和组装策略,为功能性纳米材料的设计提供了新思路。相关研究成果被Nature Communications杂志接收(DOI: 10.1038/s41467-017-01296-8);该工作已申请中国发明专利(申请专利号:201610408076.7)。
纳米材料在生物医学领域已被广泛研究和认可,例如药物递送、组织工程等均得到了深入的研究。但是,纳米材料独特的生物界面效应,也使得其在复杂生命体中的递送过程、物理化学转化以及蓄积代谢等问题变得十分棘手。因此,王浩课题组提出了“活体自组装”理念,独特设计纳米材料的建筑单元,将外源引入的分子参与到生命体的功能性组装过程中,实现了在生理环境下自发的纳米材料构建和功能化。这一独特思路,为生物医用纳米材料领域的设计和应用提供了新视角和新途径。
在纳米材料的生物功能应用中,拓扑结构对活体器官、组织和细胞的功能影响显得尤为重要。前期报道指出特定拓扑结构在生命体中扮演者独特的角色,例如双螺旋结构的DNA,具有特定3D结构的蛋白大分子,以及各种传导信号的分子复合体等等。当然,材料和界面的拓扑结构也同样影响着生物功能,例如,界面的形态会诱导干细胞定向分化、决定细胞迁移和内吞等功能。因此,深入研究在特定区域内材料拓扑结构与生物功能之间的关系,将为精准功能化纳米材料的设计提供指导。然而,目前体外构筑的纳米材料,不能区分界面和胞内作用,干扰了限域拓扑结构和生物功能关系的分析和理解。
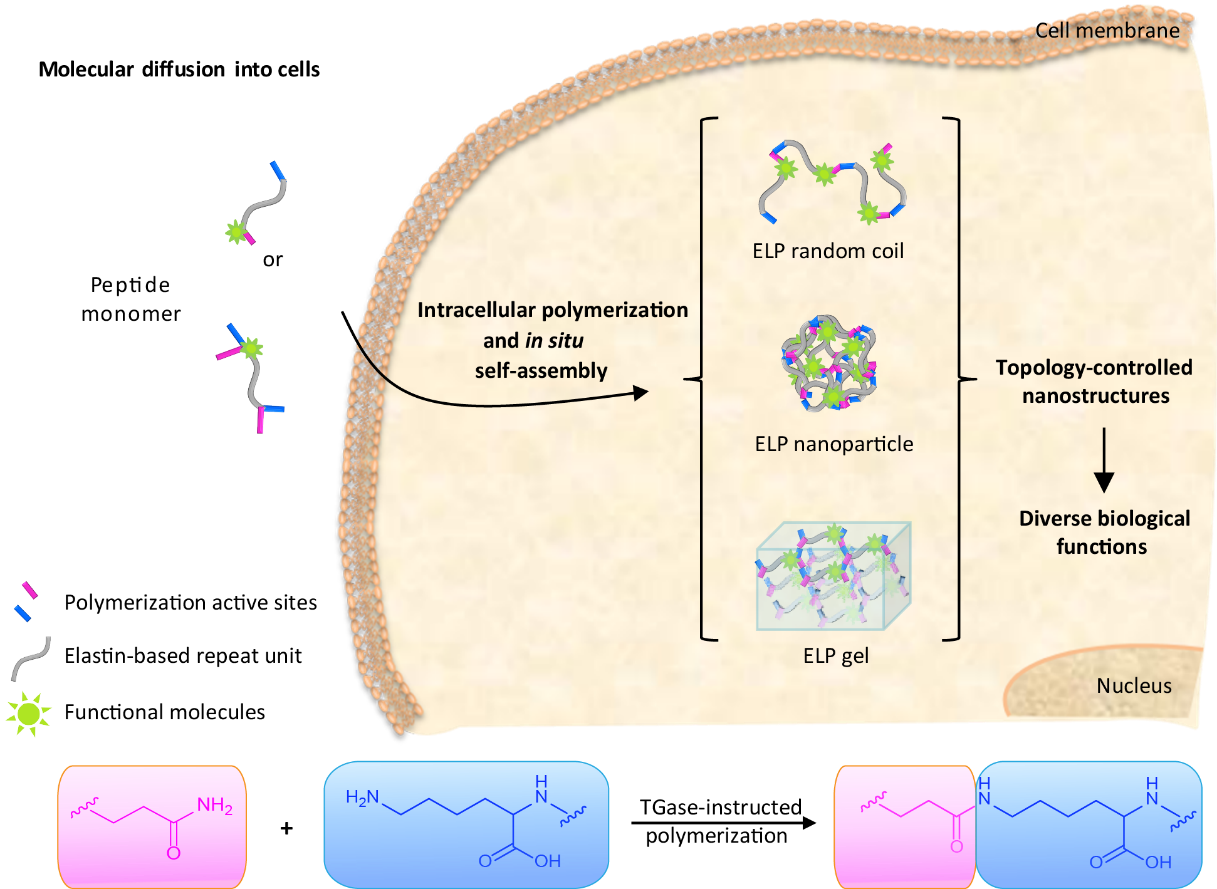
针对特定区域内材料与功能之间的关系研究,王浩课题组发展了细胞内原位聚合和组装的新方法,首次实现了在细胞内平行构筑不同拓扑结构的纳米材料,为研究胞浆拓扑结构和功能的关系提供了有效手段。通过设计不同氨基酸序列的多肽聚合单体,实现了在胞内聚合过程中,对聚合物分子量大小、温敏性质以及组装后的拓扑结构的调控;同时,在细胞和组织水平原位的证实了多肽单体的聚合和组装过程;最后,综合评价了不同拓扑结构的纳米组装体的滞留效应和细胞毒性等生物功能,为精准设计功能化纳米材料提供基础参考。
该研究得到了国家自然科学基金、创新群体项目、中科院国际合作、交叉团队、青促会等项目的支持。
