靶向蛋白降解(TPD)技术因其高度特异性,近年来在肿瘤治疗中备受关注。其中,疏水标签(HyT)作为新型TPD策略,通过引导热休克蛋白HSP70识别靶蛋白实现降解,具备分子量更小、药物利用度更高等优势。然而,由于HyT进行蛋白降解需要在HSP70识别后发生,泛素化过程不能直接介导降解,导致HyT分子引起的蛋白降解效率有限。
低温光热治疗(LTPTT)将组织加热至41-45℃以实现对肿瘤细胞产生光热损伤,可有效避免高温带来的正常组织损伤。然而LTPTT引起的HSP70的过表达提高了肿瘤细胞的热损伤修复能力,阻碍了LTPTT的进一步发展,导致其治疗效果有限。
本研究提出将HyT与LTPTT相结合协同增强肿瘤治疗。利用LTPTT诱导HSP70高表达,而HyT“阻碍”HSP70的热损伤修复功能,募集HSP70介导蛋白降解,从而增强TPD并提高LTPTT效果。基于此,研究团队构建了以BRD4为靶点的HyT类降解剂JQ-HyT,并使用UCST型温敏聚合物和聚多巴胺PDA包封JQ-HyT,开发了具备光热响应能力的功能化纳米平台JQ-NP@PDA。该平台在近红外激光808 nm照射下可实现局部升温,促进JQ-HyT释放,以HSP70为媒介,实现TPD与LTPTT疗效的协同增强。
小鼠皮下肿瘤实验显示:该纳米平台显著提升了抗肿瘤效果。该策略不仅推动了基于HyT 的蛋白质降解剂的开发,还提高了 LTPTT 的疗效。本研究提出的联合疗法有望在癌症治疗中得到广泛应用。

2025年6月23日,相关成果“Synergistic Enhancement of Hydrophobic Tag with Low-Temperature Photothermal Technique for Cancer Therapy”发表于《Small》。天津工业大学为第一完成单位,天津工业大学高辉教授、马飞贺研究员和余云健博士为共同通讯作者。本研究受到国家重点研发计划项目、国家自然科学基金项目、天津市自然科学基金重点项目资助。
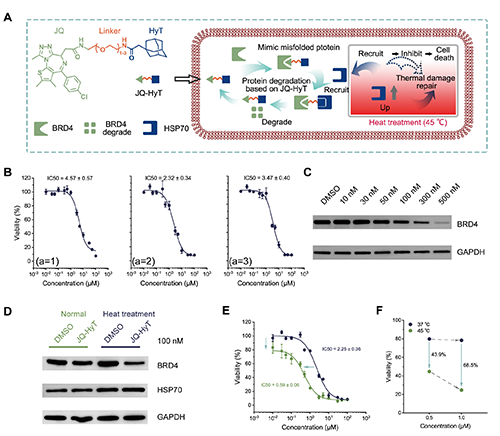
图1. 热处理与JQ-HyT联合对BRD4降解及细胞毒性的影响。
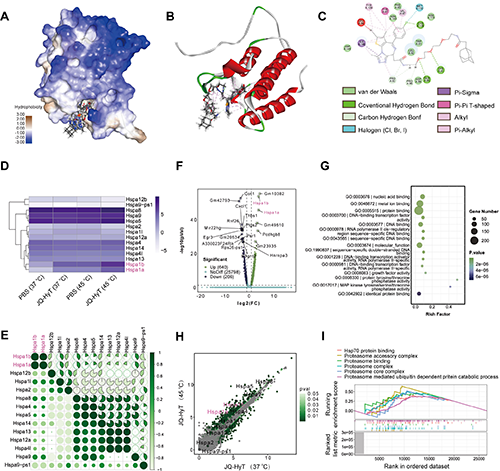
图2. 热处理与JQ-HyT联合机理。
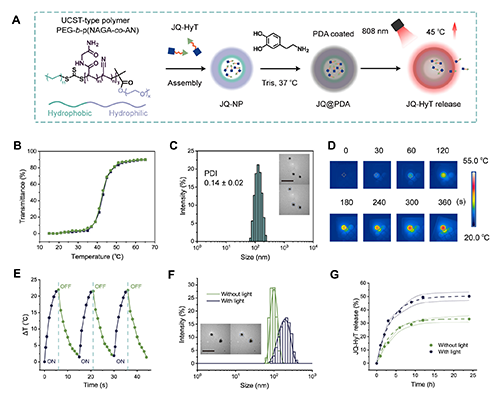
图3. 功能化纳米平台JQ-NP@PDA的制备与表征。
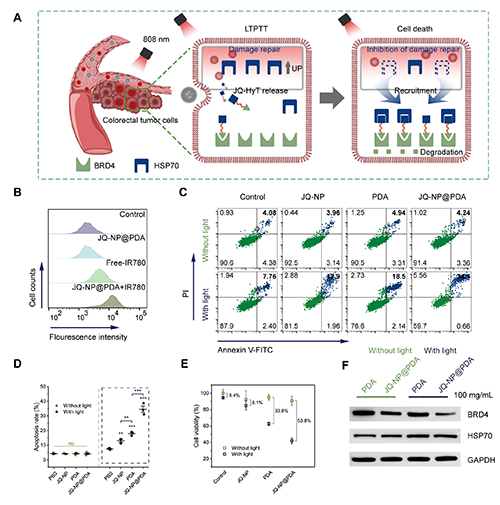
图4. 使用JQ-NP@PDA进行低温光热和BRD4蛋白降解协同治疗的细胞水平研究。
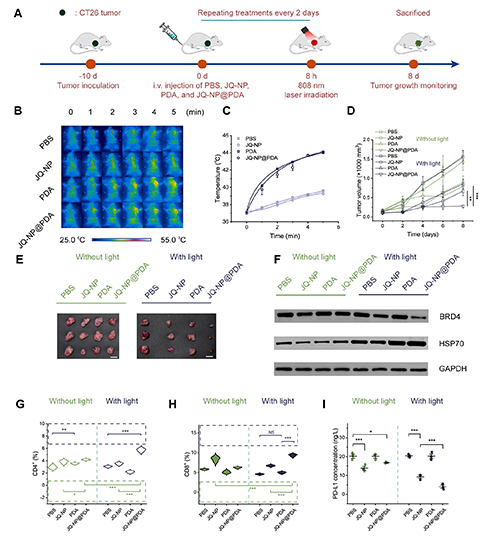
图5. JQ-NP@PDA在小鼠模型中的抗肿瘤研究。
原文链接https://doi.org/10.1002/smll.202504000
