南方医大沈折玉教授 Biomaterials: 中空介孔三氧化二铁纳米药物介导的瘤内Fe3+/2+循环催化用于大肿瘤铁死亡治疗
2024-11-01 来源:高分子科技
近年来,铁死亡(ferroptosis)作为一种新型的程序性细胞死亡方式,因其在肿瘤治疗中的潜力而受到广泛关注。铁死亡依赖于细胞内铁离子和脂质过氧化(LPO)的积累,与传统的凋亡、自噬和坏死等细胞死亡方式不同,为肿瘤治疗提供了一种新的策略。然而,内源性铁通常储存在血红蛋白、肌红蛋白、铁蛋白和转铁蛋白中,这显著限制了肿瘤铁死亡的治疗效率。因此,直接将外源性铁(Fe)输送至肿瘤区域,是提升铁死亡疗法效果的一种传统而有效的策略。尽管Fe2+能够通过Fenton反应产生羟基自由基(?OH),并在此过程中转化为Fe3+(Fe2+ + H2O2 = Fe3+ + ?OH + OH-)。然而,Fe3+通过另一Fenton反应逆转为Fe2+的速率却很缓慢(Fe3+ + H2O2 = Fe2+ + ?OOH + H+)。这一缓慢的转化过程严重限制了铁死亡疗法在治疗大肿瘤方面的疗效。

图1. 复合纳米药物CDDP@GP@HMISN@LAC的构建及其利用Fe3+/2+循环催化的机制治疗大肿瘤的示意图。
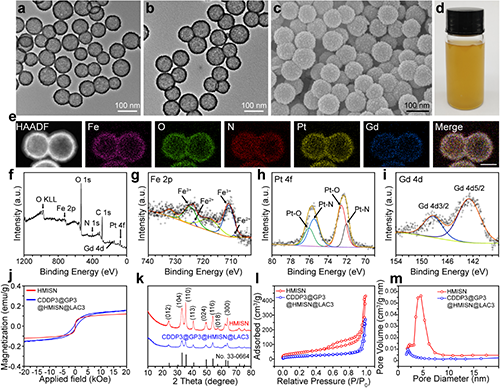
图2. CDDP@GP@HMISN@LAC的制备与表征。
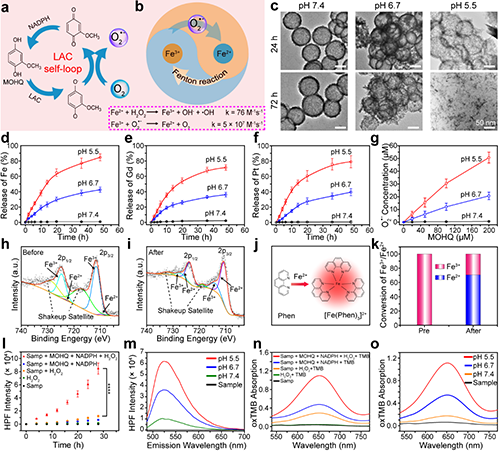
图3. CDDP@GP@HMISN@LAC在酸性条件下降解以及催化Fe3+/2+的表征。
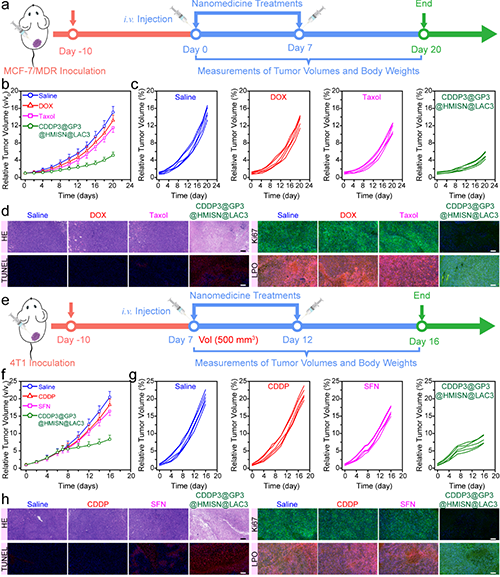
图4. 复合纳米药物CDDP@GP@HMISN@LAC的用于MCF-7/MDR耐药肿瘤模型和500 cm3大肿瘤模型的治疗评价。
原文链接:https://doi.org/10.1016/j.biomaterials.2024.122793
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 烟台大学/潍坊中医药产研院陈大全教授团队 JCR: 仿生活性氧/氮纳米清除剂抑制“铁死亡风暴”调节免疫靶向急性肾损伤 2025-01-10
- 南华大学喻翠云/魏华/张海涛团队 JNB:调控组氨酸磷酸酶-铁死亡串扰 - 用于肝细胞癌高效治疗及其机制的研究 2024-10-18
- 王浩/徐万海/乔增莹/孙涛垒《Nat. Commun.》:体内组装增强结合效应增强肿瘤特异性铁死亡治疗 2024-01-16
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
