牙周炎是一种由菌斑引起的感染性、破坏性疾病,是导致成年人牙齿松动和缺失的主要原因。菌斑即生物被膜(biofilm),具有由多糖、蛋白质、核酸以及细胞碎片构成的胞外基质(EPS),能极大地阻碍抗生素渗透,导致抗生素治疗牙周炎困难重重。
为解决上述问题,同济大学杜建忠教授团队基于前期关于抗菌囊泡的研究基础,设计了一种双冠囊泡,不仅能有效针对生物被膜进行抗生素递送,而且能大幅减少抗生素剂量。该囊泡由两种嵌段共聚物共组装而成。如图1所示,PCL链段形成囊泡膜(蓝色),而PEO链段(粉红色)、抗菌肽链段(绿色和棕色)则分别形成囊泡的“双冠”。其中,PEO冠层能够抵抗蛋白质粘附,从而降低生物被膜中EPS对囊泡的阻碍,促进抗生素深入生物被膜;而抗菌肽冠层则为囊泡表面提供正电荷,使其能吸附到细菌表面并通过膜破坏机理杀菌,结合囊泡释放的抗生素,更有效地破坏生物被膜。
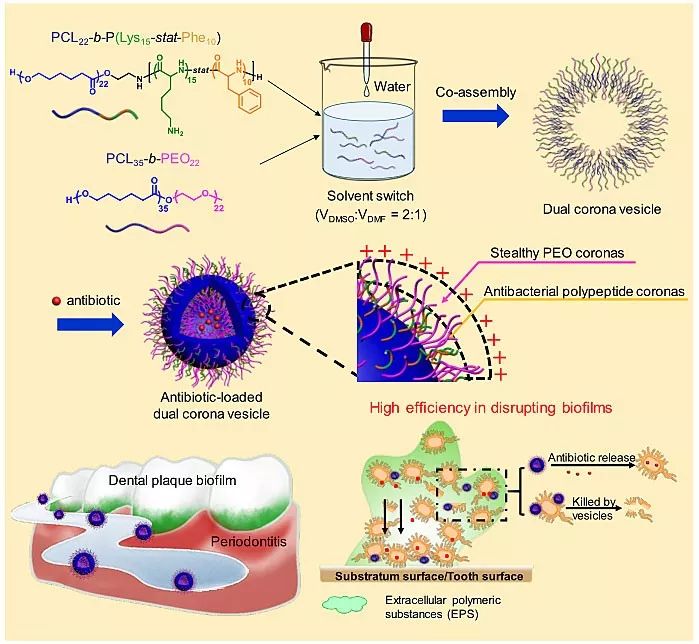
图1. 载药双冠囊泡高效破坏牙周炎生物被膜示意图。
团队首先通过5项体外实验对载药双冠囊泡抗生物被膜性能进行了定性及定量测试。最小生物被膜清除浓度测试表明,双冠囊泡包载正常抗生素用量的50%即可达到同样的生物被膜清除效果。结晶紫染色实验比较了包载前后相同浓度抗生素对生物被膜的破坏量,从中可以看出双冠囊泡比单冠囊泡能更好地增强抗生素抗生物被膜性能。荧光显微镜和扫描电子显微镜分析表明,通过载药双冠囊泡治疗后,死细菌红色荧光强度增加,致密的生物被膜结构被破坏,底层的细菌也被杀死。激光共聚焦显微镜层扫结果更直观地揭示了载药双冠囊泡(蓝色荧光)有效地渗入并聚集在生物被膜内部,杀死了大量细菌(绿色荧光)(图2)。
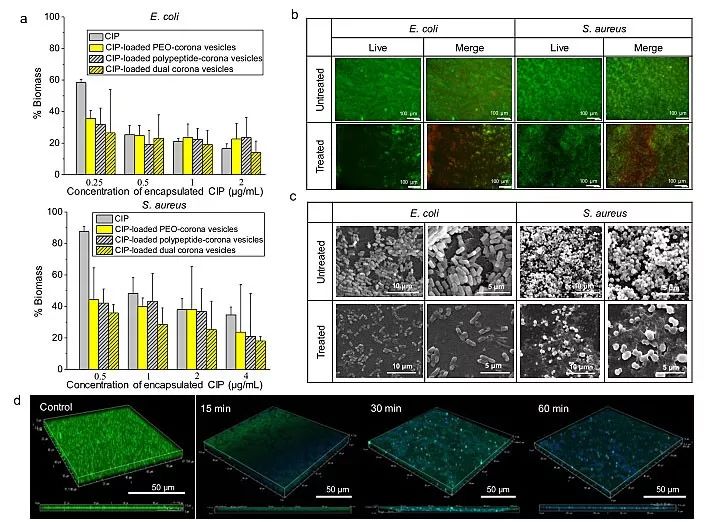
图2. 载药双冠囊泡有效破坏生物被膜(体外实验):(a) 结晶紫染色结果;(b)活死细菌染色荧光图像;(c) 扫描电子显微镜图像;(d) 共聚焦层扫图像。
团队进一步利用实验性牙周炎大鼠模型研究了载药双冠囊泡的体内治疗效果。通过碱性品红染色法、扫描电镜和标准平板计数法评估了载药双冠囊泡破坏牙菌斑的效果(图3)。品红染色及扫描电镜结果表明,牙菌斑覆盖面积减少;而标准涂板法则进一步验证了该体系能大量杀死生物被膜内的细菌。实验发现,通过双冠囊泡的包载,仅用原来50%的抗生素就可以达到相同的治疗效果。团队进一步以探诊出血指数、牙槽骨三维微计算机断层扫描图像、牙周组织病理切片为评价指标,表征了其减轻牙周炎症反应的效果。经载药双冠囊泡治疗后,实验组具有最低的探诊出血指数,而牙槽骨的CT扫描图像和组织切片也显示出治疗组比牙周炎组的骨丢失更少,有效防止了炎症的进一步恶化(图4)。
这种双冠囊泡策略能更好地应对生物被膜的复杂环境,大大降低了抗生素剂量,为今后设计多功能抗菌材料提供了新思路。

图3. 载药双冠囊泡有效破坏菌斑生物膜(体内实验):(a) 实验性牙周炎建模以及局部用药示意图;(b) 牙菌斑品红染色照片及SEM图像;(c-d) 标准平板计数法结果。
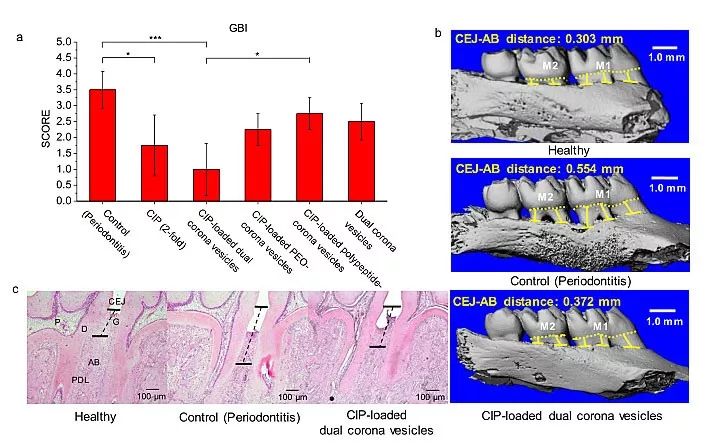
图4. (a) 局部治疗后探诊出血指数; (b) 牙槽骨3D断层扫描图像; (c) 牙周组织病理切片染色结果。
这一成果近期发表在ACS Nano 上,同济大学硕士研究生奚悦静、王月和高婧宜为文章的共同第一作者,杜建忠教授为通讯作者。
- 华东理工大学刘润辉教授课题组《J. Med. Chem.》:模拟宿主防御肽的高效抗菌多肽聚合物展示治疗溃疡慢性感染和免疫调节功能 2020-11-02
- 西南医大口腔医院陶刚/黎春晖/蔡蕊团队:具有ROS触发药物释放特性的可注射水凝胶实现抗菌剂和抗炎纳米颗粒协同递送用于牙周炎治疗 2025-04-15
- 四川大学李继遥/梁坤能/杨佼佼 CEJ:贻贝启迪的湿粘附长效抗菌水凝胶用于牙周炎的治疗 2025-03-12
- 北京化工大学徐福建教授团队 AM:可适应强湿粘附水凝胶用于长期保护牙周炎伤口 2024-11-28
- 苏大李刚、附一院李峰和附四院沈罡 IJBM: 兼具抗菌和抗狭窄功能的载药可降解输尿管支架 2025-06-29
- 上海交大庞燕团队 Sci. Adv.:原位“两面神”载药涂层 可实现持久舒适的眼表给药 2025-03-13
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
