胞内金黄色葡萄球菌不仅能在细胞内寄生以逃避免疫清除,还能在持续高剂量抗生素作用下进入持留状态,抵御抗生素杀伤。持留菌作为一类表型变异的细菌亚型,被视作细菌“不死之谜”,是细菌感染难以根除的关键原因。目前,现有清除策略与药物多针对浮游型持留菌,对胞内持留菌的研究仍较有限。这是由于胞内复杂微环境(如细胞膜屏障、酸性环境、酶降解等)及宿主-细菌动态相互作用的多重限制,导致现有策略与药物难以发挥作用。
针对胞内持留菌难以清除的挑战,北京化工大学王兴/李国锋团队在系统综述持留菌生态位及清除策略的基础上(Microbiological Research. 2025, 297, 128189),依托在聚氨基酸递送系统研发(Polym. Chem. 2018, 9, 2733;Biomacromolecules. 2021, 22, 4871;Colloid Surface B. 2021, 202, 111687;ACS Nano. 2024, 18, 8017)及胞内菌清除研究(Adv. Mater. 2022, 34, 2109789;J. Mater. Chem. B 2023, 11, 2958;Macromol. Biosci. 2023, 23, 2200311)的技术积累,先前提出了具有级联靶向功能的聚氨基酸纳米粒子 FAlsBm@Rif,通过现场递送丝氨酸重编程细菌发酵途径,成功逆转金黄色葡萄球菌的持留性状态并实现清除(ACS Nano. 2025, 19, 26075)。在此基础,研究团队利用具有级联靶向功能的聚氨基酸纳米递送平台F(AM),探究了现场递送抗生素对胞内持留菌的清除效果(图1)。研究团队系统筛选了 11 种抗生素,并将其包载于 F(AM) 中评估持留菌清除效果。结果显示,西他沙星(Sit)与利福平(Rif)对胞内持留菌具有显著杀灭作用,而 F(AM) 载药平台进一步放大了抗生素效力,通过精准递送显著提高局部药物浓度,从而增强了对持留菌的清除效率。

图1: F(AM)纳米颗粒的构建及其对胞内持留性金黄色葡萄球菌的抗菌性能:(a)F(AM)纳米颗粒的构建;(b)F(AM)载药纳米颗粒通过原位递送抗生素清除胞内持留性金黄色葡萄球菌。
文章要点:
(1)不同作用机制的抗生素对金黄色葡萄球菌的评价
研究团队根据其先前发表在Microbiological Research (doi: 10.1016/j.micres.2025.128189) 的综述系统总结分类了清除持留菌的策略,并讨论了不同抗生素在清除持留菌中的作用和潜力,具有不同机制的药物可能对持续性细菌产生显著不同的影响。因此,选择了四类具有不同作用模式的抗生素,包括:i)细胞壁合成抑制剂(例如,β-内酰胺类),ii)膜破坏剂(例如,多粘菌素类),iii)蛋白质合成抑制剂(例如,氨基糖苷类),和iv)核酸合成抑制剂(例如,氟喹诺酮类)。首先测定这些抗生素对金黄色葡萄球菌的最小抑菌浓度和最小杀菌浓度,以评估它们的自身抗菌活性。
(2)浮游持留菌的构建与抗生素筛选
研究团队首先建立了以万古霉素诱导形成的持留菌模型。结果显示,该模型呈现出持留菌典型的双相杀伤曲线,并在复苏前后保持一致的最小抑菌浓度,验证了持留菌的成功构建。在随后的抗生素筛选实验中,研究团队系统评估了11种机制各异的抗生素对浮游持留菌的清除效果,结果表明Sit、Rif和多粘菌素B(PMB)对浮游型持留菌的清除效果最佳(图2)。

图2: 浮游型持留菌的构建验证以及抗生素筛选评价
(3)胞内持留菌的构建与抗生素筛选
在浮游型持留菌的基础上,研究团队进一步构建了胞内持留菌模型,同样展示出双相杀伤曲线。研究团队系统评估了11种抗生素对胞内持留菌的清除效果。结果显示, Sit、Rif 和 PMB 展现出最优的抗持留菌能力,成为靶向浮游及胞内持留菌的最具潜力候选药物(图3)。

图3: 胞内持留菌的构建验证以及抗生素筛选评价
(4)F(AM)对持留菌的特异性靶向
F(AM) 通过 PET-RAFT 聚合合成,表面引入氨基丙氨酸和甘露糖基团,以实现对细菌和宿主细胞的级联靶向。研究结果显示,F(AM) NPs对敏感菌和浮游型持留菌均表现出较强的靶向性,其与两者的共定位皮尔森系数(PCC) 值分别为 0.92 和 0.86,差异无统计学意义。同时,F(AM) NPs 可通过甘露糖受体介导的途径快速进入宿主细胞,并对胞内敏感菌和胞内持留菌保持有效靶向作用,共定位 PCC 值分别约为 0.76 和 0.73。结果表明,细菌的持留状态对 F(AM) 的靶向能力影响不大(图4)。
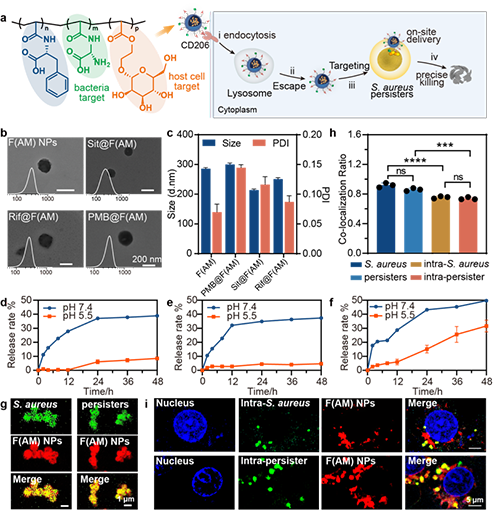
图4: F(AM)载药微球的构建表征以及特异性靶向激光共聚焦图像
(5)纳米载药粒子的制备与持留菌清除效果评估
研究团队将 Sit、Rif 和 PMB 分别负载于 F(AM) 纳米平台,制备 Sit@F(AM)、Rif@F(AM) 和 PMB@F(AM) 纳米颗粒。所得纳米粒子在 pH 7.4 及pH 5.5下均保持结构稳定与缓释行为(图4)。在浮游型持留菌中,Rif@F(AM) 与 Sit@F(AM) 的杀灭率分别达 99.4% 和 99.96%,均优于游离药物;PMB@F(AM) 亦略有提升。在胞内持留菌清除评价中,Rif@F(AM) 与 Sit@F(AM) 的杀菌率仍保持在92%和96%,显著优于游离药物,而 PMB@F(AM) 未显优势(图5)。综上,Sit@F(AM) 与 Rif@F(AM) 在两种模型中均展现出卓越的持留菌清除能力,验证了 F(AM) 作为精准抗菌纳米平台的应用潜力。
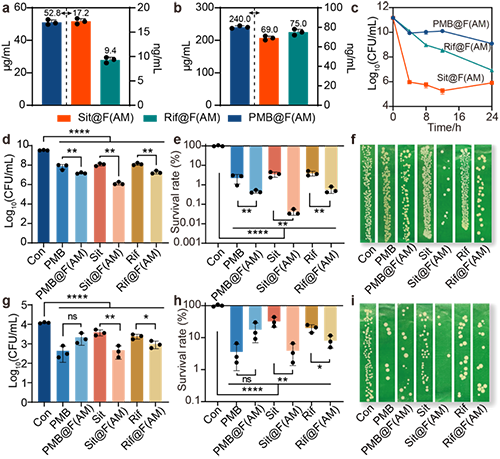
图5: F(AM) NPs对浮游以及胞内持留菌的抗菌评价
(6)Sit@F(AM)清除体内持留菌的抗菌评价
Sit@F(AM) 在清除体内持留菌方面展现出显著优势。相比于游离 Sit 组中仍残留大量细胞外细菌(约103 CFU),Sit@F(AM) 处理组的细菌负荷显著降低,几乎检测不到细胞外细菌。同时,Sit@F(AM) 组中未检测到任何细胞内持留菌,而游离 Sit 处理的小鼠细胞内细菌负荷仍高达约103 CFU(图6)。

图6: Sit@F(AM)体内清除持留菌
(7)F(AM)增强抗生素清除持留菌活性的机制
与游离Rif相比,Rif@F(AM)在浮游持留菌中胞内持留菌中展现出更高的局部富集能力,进一步验证其靶向递送优势。另外,在酸性和氧化应激等感染相关微环境下,Rif和PMB的抗菌活性受损,而包载于F(AM)后能有效缓解这一影响。相比之下,Sit 及其纳米制剂未受明显影响,显示出良好的稳定性。同样的用CCCP抑制质子动力后发现,PMB受其影响较大,但是Sit和Rif不受影响,F(AM)还可以缓解这一影响(图7)。
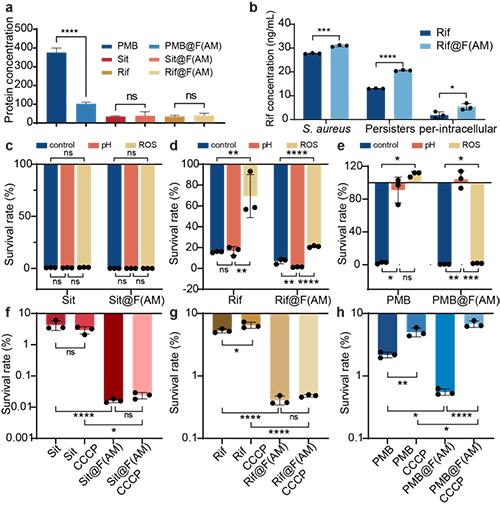
图7: F(AM)纳米颗粒介导持留菌清除的机制
综上所述,本研究构建了一种具备双重靶向能力的F(AM)现场递送平台,能够同时靶向宿主细胞及其胞内持留菌,高效穿越细胞屏障,并实现抗生素在细菌生态位的现场释放。该平台在体内外模型中均表现出显著优于游离抗生素的持留菌清除效果。该策略不仅提供了一种强有力的手段以根除胞内持留菌感染,也为优化细胞内抗生素疗法提供了新的机制视角与思路。
相关研究成果近期以“Eradication of Intracellular Staphylococcus aureus Persisters via On-Site Antibiotic Delivery by Poly(amino acid) Nanoparticles”为标题发表在学术期刊ACS Applied Materials & Interfaces上。本论文第一作者为北京化工大学生命科学与技术学院的尹子博,李国锋副教授和王兴教授为论文的共同通讯作者。该研究得到国家自然科学基金、中央高校基本科研业务费和北京大学第三医院创新与成果转化项目的资助与支持。
文章链接:https://doi.org/10.1021/acsami.5c11777
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 宁波大学陈重一教授 ACS Macro Lett.:基于螺旋结构聚氨基酸的强力生物粘合剂 2025-03-07
- 北化徐福建/赵娜娜/申鹤云《ACS Nano》:两亲性聚氨基酸纳米佐剂介导的光热增强免疫治疗 2024-11-13
- 吉林大学钱虎军教授团队 PRL:单链纳米粒子突破高分子材料“强度-韧性-加工性”三难困境 2025-10-15
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 华工殷盼超/广工尹家福团队 Nano Lett.:软纳米粒子多时空动力学解析 2025-08-21
- 南林蒋少华教授团队 ACS Nano:肺泡仿生木材工程构建超高通量高效抗生素去除材料 2025-12-26
