伤口渗出液在组织修复过程中具有双重调控作用。尽管渗出液中含有的生长因子、营养物质可为细胞提供养分并加速组织再生,但伤口愈合初期产生的过量渗出液会导致组织过度水合,增加感染风险并延缓愈合进程。更重要地是伤口后期渗出液大幅减少,有可能影响细胞迁移和增殖,延迟伤口愈合并导致瘢痕形成。针对这一关键问题,本研究开发了一种具有渗出液响应特性的智能抗菌敷料,实现了在愈合初期通过单向导湿效应高效导出过量渗出液,而在中后期自动调节导湿功能以维持适宜的伤口微环境,从而优化整个愈合过程。
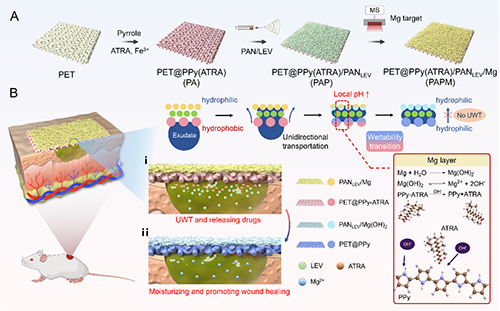
图1.渗出液响应性多功能抗菌敷料(PAPM)的设计原理及其动态调控伤口微环境的机制
近期,西南大学Kang En-Tang教授团队开发了一种具有渗出物响应特性的PAPM多功能敷料,能够根据伤口愈合进程自主调控微环境湿度。这种新型敷料采用三层结构设计(图1):(1)具有pH响应性润湿转换特性的疏水织物层;(2)负载抗菌剂的电纺纤维层;(3)通过磁控溅射技术沉积的镁(Mg)功能顶层。研究团队利用不对称润湿性和孔径梯度,实现了在愈合初期将过量渗出液单向传导至敷料外层。当渗出液与Mg层接触时,二者反应不仅提高了局部pH值,同时产生的热量加速了水分蒸发,从而维持了前期的单向导水功能。当PAPM敷料发生响应性转变后,其功能由导水变为储水,为后期的伤口愈合提供适宜的湿度。
值得注意的是,pH值的变化会触发疏水层中聚吡咯(掺杂疏水性抗炎药物)发生氧化还原诱导的润湿性转变(图2)。随着抗炎药物的缓释,疏水层逐渐转变为亲水状态,开始发挥保水功能。同时,Mg与水反应生成的氢氧化镁在敷料表面形成致密屏障,终止了单向传导过程,为愈合后期提供了适宜的湿润环境(图3)。体内实验证实,PAPM敷料展现出优异的抗菌性能和促愈合效果(图4)。转录组学分析进一步表明,该敷料能有效抑制伤口炎症反应,促进组织再生(图5)。这项研究为感染性伤口的智能化治疗提供了新思路。

该工作以“A Multilayered Responsive Dressing for Programmable Exudate Control and Regenerative Therapy of Infected Wounds”为题发表在《Advanced Functional Materials》上(Adv. Funct. Mater. 2025, e14784)。该论文的第一作者为西南大学二年级博士生张志成,通讯作者为Kang En-Tang教授、徐立群教授和鲁志松教授。陆军军医大学于云龙研究员和伊斯法罕科技大学Mahshid Kharaziha副教授为本研究工作提出诸多宝贵意见建议。研究工作得到了国家重点研发计划、国家自然科学基金和中央高校基本科研业务费等项目的支持。
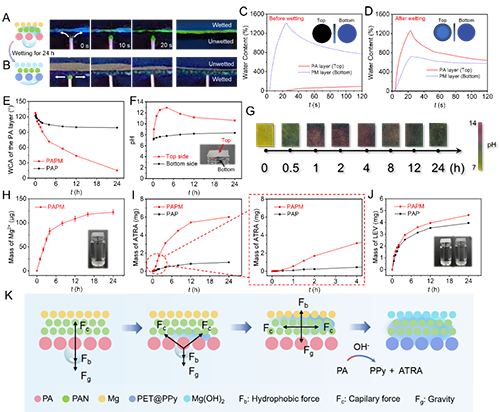
图2.PAPM复合敷料的单向导湿机制、润湿性转变及药物释放特性研究
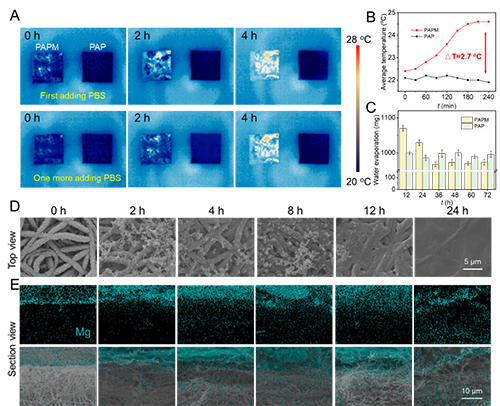
图3.PAPM复合敷料在吸收渗出液后的自发热特性、水分蒸发动力学及结构功能演变
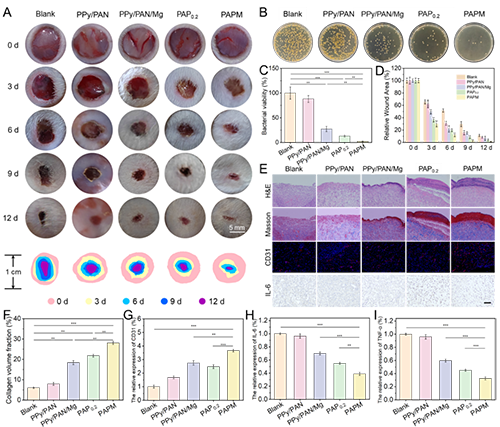
图4.PAPM复合敷料的体内抗菌效果评估及伤口愈合促进作用
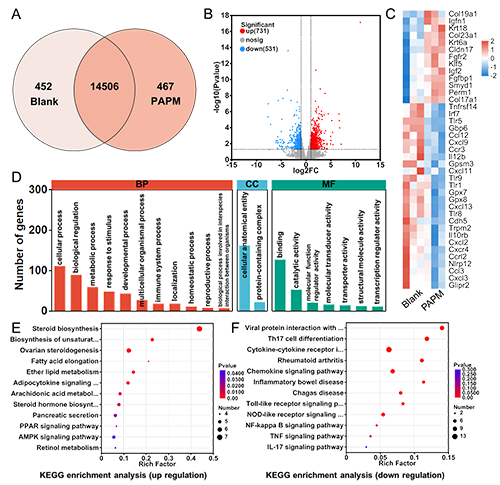
图5.PAPM复合敷料治疗组伤口组织的转录组学分析及分子机制研究
本研究是团队在渗出液响应型伤口敷料研发领域取得的最新进展。伤口渗出液作为影响愈合微环境的关键因素,发挥至关重要作用。基于此,研究团队前期开发了具有渗出液响应特性的电活性抗菌敷料(Adv. Funct. Mater. 2024, 34, 2405114),通过吸收渗出液激活纱线基纤维电池为伤口持续供能,实现了对渗出液的有效管理与高效利用,为加速感染性伤口愈合提供了新策略。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adfm.202514784
- 暂无相关新闻
