合成高载药量的纳米药物一直是一项极具挑战的任务,而实现此类纳米药物的普遍适用、连续化、大规模生产更是难上加难。近日,四川大学李旭东教授、陈君泽教授与香港城市大学谭超良教授团队合作,提出了一种基于多酚-氨基酸缩合物的可扩展材料库,成功实现了超高载药量纳米药物的高效连续生产。该研究成果发表在Advanced Materials期刊上。
研究亮点:
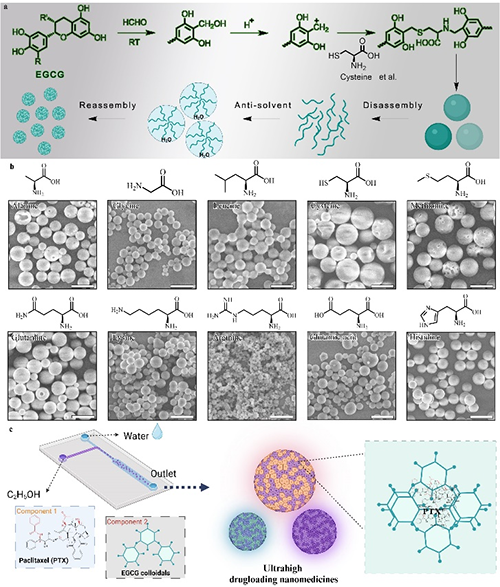
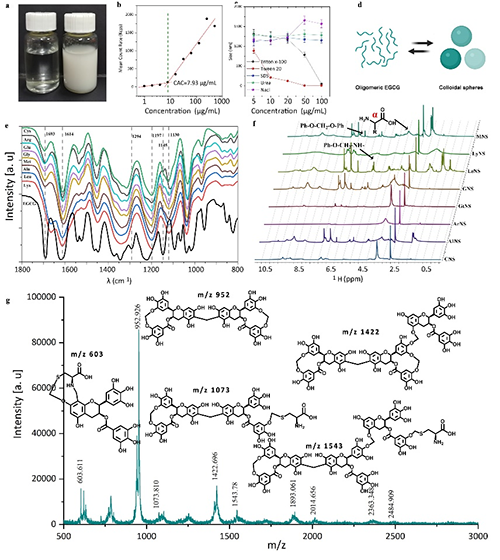
多功能材料库:本研究通过选择不同的氨基酸,提供了一种多酚-氨基酸缩合物胶体球材料库。该策略能够精确调控载体的关键特性,如载药能力、生物活性、临界聚集浓度等,为不同应用场景提供了多样化的选择。
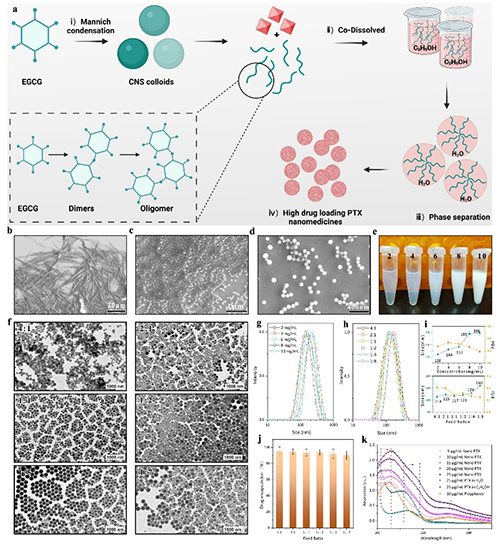
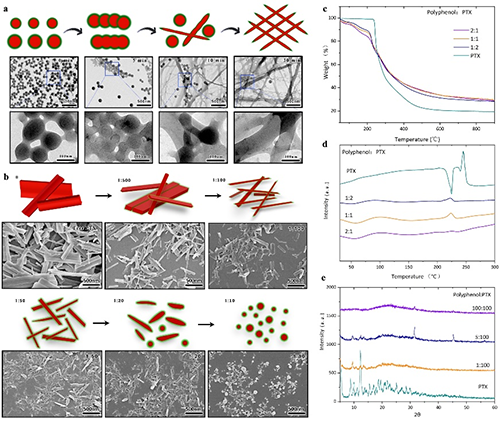
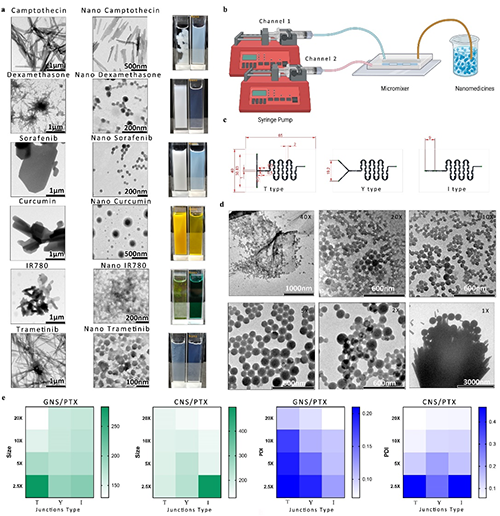
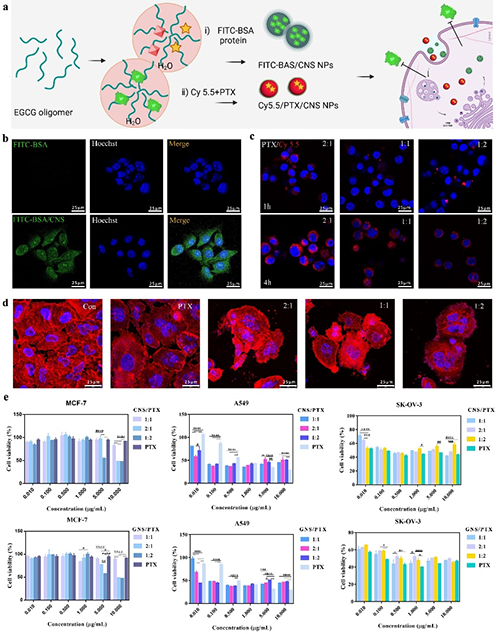
超高载药量:通过溶剂介导的缩合物分解与重组,紫杉醇(PTX)的载药量最高 86%。对于多种难溶性药物分子,载药量均超过50%,显示出广泛的适用性。
连续化生产:利用微流控技术,纳米药物的生产效率可达5 mL/min(每天36克),且纳米颗粒的尺寸可精确调控,多分散指数(PDI)低于0.2。
研究背景:
目前,约40%的市场化药物和90%的临床候选药物存在水溶性差的问题,导致其生物利用度低、疗效受限。传统的纳米药物递送系统通常载药量较低(<10%),需要多次给药和大剂量载体,增加了治疗复杂性和潜在的健康风险。因此,开发高载药量的纳米药物递送系统迫在眉睫。将药物通过研磨、超声处理和高压均质化等方法粉碎至纳米尺度,是生产高药物含量纳米颗粒(如纳米晶药物)的最直接方法之一。然而,这种方法通常需要高能量或高压输入,且尺寸缩减的效率受到限制,特别是对于100纳米以下的纳米颗粒。此外,该过程通常需要使用专门的稳定剂。乳液法和纳米沉淀法是广泛用于制备载药聚合物纳米颗粒的技术。使用聚合物薄膜水化法制备聚(2-噁唑啉)聚合物纳米颗粒时,共载紫杉醇(PTX)和姜黄素的载药量可达56%。与乳液法相比,纳米沉淀法提供了更简单、更具成本效益的方法,并且无需外部能量输入。通过机器学习和高通量实验的广泛筛选,已经鉴定出几种具有高载药量的自组装纳米颗粒。此外,利用定量结构-纳米颗粒组装预测(QSNAP)模型开发了一种基于染料的靶向递送系统,该系统实现了极高的载药水平。一种浓度控制的连续纳米沉淀法,称为盐诱导纳米沉淀法,已被开发用于制造载药量高达66.5 wt%的聚合物纳米颗粒。冰模板法也被报道用于制备无载体纳米药物。但是这些方法的连续生产受到多种原因的限制。
微流控纳米沉淀技术通过利用流体扩散、混合、乳化或其组合,实现了各种纳米材料的连续生产。微流控技术具有显著的优势,包括自动化、提高生产效率和可重复性。微流控系统中对流体混合动力学和环境参数的精确控制优化了自组装过程,促进了快速生产。微流控设备的封闭性质也支持无菌颗粒制备。尽管微流控技术已应用于合成各种载药纳米颗粒,但所得载体通常表现出低载药量。例如,使用流动聚焦微流控设备时,mPEG-PLGA对姜黄素的最高载药效率为3.4%。在使用微流控技术组装的紫杉醇载药PLGA纳米颗粒中,载药量范围约为1%至7%。微流控技术是生产纳米药物的重要新兴技术,但在生产高载药量纳米药物领域仍鲜有探索。
创新方法:
李旭东教授团队一直致力于通过天然酚类化合物开发治疗性纳米功能材料,例如基于氧化偶联的多孔微球(J. Am. Chem. Soc. 2013, 135, 4179?4182),粒径精确可控的蛋白多酚纳米粒(J. Mater. Chem. B, 2018,6, 1373),聚合多酚多功能材料(ACS Appl. Mater. Interfaces 2020, 12, 34, 37914-37928;ACS Appl. Mater. Interfaces 2020, 12, 30, 33550-33563;ACS Sustainable Chemistry & Engineering;J. Mater. Chem. B 2023, 11, 11505-11518),可食用超小多酚纳米酶(Chemical Engineering Journal 500 (2024) 157090)。
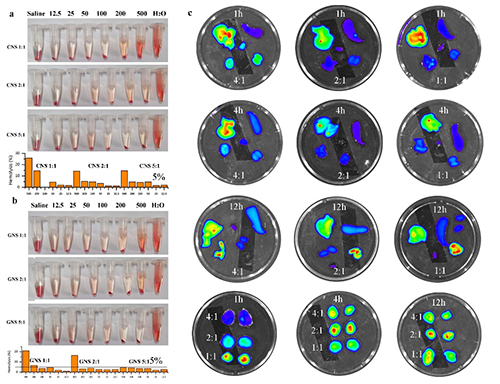
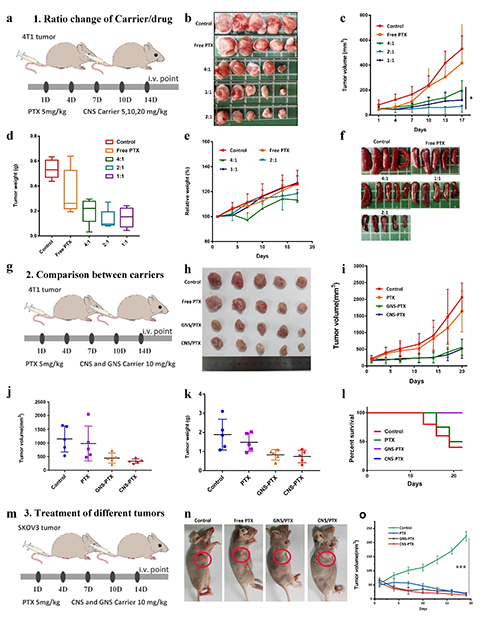
此研究中团队以天然茶多酚(EGCG)为原料,通过选择不同的氨基酸,构建了一个多酚-氨基酸胶体球库,这些胶体球具备可重复解组装和再组装的性能。研究人员,利用微流控技术胶体球的性能结合,同时实现了高载药量和连续高通量生产。该研究不仅为纳米药物的高效生产提供了新思路,还为解决难溶性药物的递送难题提供了创新方案。基于多酚的纳米载体不仅具有高载药量,还具备优异的生物相容性和治疗效果,未来有望在肿瘤治疗、炎症性疾病治疗等领域发挥重要作用。
论文信息:
A Library of Polyphenol-Amino Acid Condensates for High-Throughput Continuous Flow Production of Nanomedicines with Ultra-High Drug Loading
Zeng Yi, Xiaomin Ma, Qiulan Tong, Lei Ma, Yunfei Tan, Danni Liu, Chaoliang Tan*, Junze Chen*, Xudong Li*(李旭东,四川大学)
Advanced Materials, 2025, DOI: 10.1002/adma.202417534
https://doi.org/10.1002/adma.202417534
第一作者信息介绍
易增,四川大学生物医学工程学院专职科研岗副研究员。主要从事“天然酚类功能材料和纳米药物” 在组织修复、消化系统疾病和肿瘤防治相关研究,在Advanced Materials, Chemical Engineering Journal,Green Chemistry, ACS Appl. Mater. Interfaces, ACS Sustainable Chemistry & Engineering, Carbohyd. Polym., J. Mater. Chem. B, ACS Biomaterials Science & Engineering, Colloids and Surfaces B Biointerfaces, ACS Applied Nano Materials等期刊发表系列SCI论文,研究成果入选ACS Editors’ Choice编辑推荐亮点文章,J. Mater. Chem. B HOT paper栏目,获授权国家发明专利4项。
马晓敏,四川大学华西医院专职科研岗副研究员。获得国家自然科学基金青年项目,四川省自然科学基金青年项目等多项基金的支持。主要从事“新型递送平台的构筑及其在呼吸系统相关疾病精准诊疗中的应用研究”,在Adv. Mater.、Adv. Healthc. Mater.、Chem. Eng. J.、Carbohyd. Polym.、ACS Appl. Mater. Interfaces、Inorg. Chem.、J. Mater. Chem. B、ACS Sustainable Chem. Eng.、Colloid. Surface. B及ACS Appl. Nano Mater.等期刊发表多篇SCI论文。
通讯作者信息介绍
谭超良,香港城市大学电机工程系终身副教授,博导,国家优秀青年基金(港澳)获得者(2021)。2024年当选“国际先进材料协会会士”,2018-2024年连续7年入选“全球高被引科学家”(科睿唯安),2020-2024年连续5年入选“世界前2%科学家”(斯坦福大学),2022-2024年连续3年入选“全球顶尖前10万科学家”榜单(全球学者库)。研究涉及二维材料、电子器件、光电探测器、人工智能芯片、生物纳米材料和纳米医学等多学科交叉领域。在Nature、Nat. Nanotechnol.、Nat. Rev. Mater.、Chem. Rev.、Chem. Soc. Rev.、Nat. Commun.、Adv. Mater.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.等国际知名期刊上发表SCI论文190余篇,其中39篇入选ESI高被引论文,论文总引用33000余次,H因子83,担任《Smart Materials and Devices》副主编,担任《物理化学学报》、《Science Bulletin》、《Nanomaterials》和《Energies》编委,2023年Advanced Materials期刊“明日之星”,2022年Small期刊“明日之星”,2023年Materials Chemistry Frontiers期刊和2021年Journal of Materials Chemistry A期刊“新锐科学家”。
陈君泽,四川大学特聘研究员,博导,四川大学双百人才项目入选者。主要从事纳米异质结构的液相制备与性能研究。已在Nat. Chem.、Nat. Commun.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Adv. Mater.、Chem. Rev. 等国际著名SCI学术期刊上发表论文40余篇,他引8000余次。授权专利3项。
李旭东,四川大学二级教授,博导,在天然茶多酚功能纳米化方面取得了一系列研究成果,包括天然氨基酸诱导的茶多酚自组装、模块化灵活调控茶多酚纳米粒性能、茶多酚协同光动治疗、纯天然多酚防晒乳剂、茶多酚-姜黄素联合治疗AKI和茶多酚Pickering乳剂系列工作。这些工作将天然茶多酚功能分子转化为具有功能作用的载体平台,为天然多酚新型纳米材料的合理设计和制备提供了新的平台技术,将极大推进天然多酚新材料的开发应用。长期从事组织修复与再生用纳米结构/功能生物材料和植物多酚资源利用的研究,先后承担国家973计划项目课题、国家自然科学基金委项目和四川省科技攻关项目。发表一系列的研究论文和获十多个授权国家发明专利,论文成果入选英国皇家化学会、美国化学会和自然中国研究亮点推荐。
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 天工大高辉/李晓晖团队 Acta Biomater.:二甲双胍多功能纳米药物克服具核梭杆菌介导的结直肠癌化疗耐药与免疫抑制 2025-02-11
- 海南大学黄玮/张明鑫团队 JACS:浓盐水直接分离 2026-02-09
- 南林蒋少华教授团队 ACS Nano:肺泡仿生木材工程构建超高通量高效抗生素去除材料 2025-12-26
- Science:AI和高通量结合的逆向分子设计加速材料发现 2024-12-14
