面神经损伤(FNI)仍是临床重大挑战,常导致严重功能障碍及社会负担。施万细胞在神经修复中起关键作用,但其再生能力受到损伤部位缺氧微环境的限制。为此,他们开发了光响应性小球藻水凝胶(C-Gel),可在光照下控制释氧,并探究其治疗机制。体外实验表明,光照下的C-Gel显著促进RSC96施万细胞的增殖、迁移及分泌功能,同时降低活性氧(ROS)、缺氧诱导因子-1α(HIF-1α)、肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)水平。此外,C-Gel调控巨噬细胞极化,促使其由促炎性M1表型(iNOS与TNF-α高表达)向抗炎性M2表型(Arg-1与IL-10表达增加)转化。M2条件培养基进一步诱导施万细胞分泌神经营养因子(NGF、GDNF)、黏附分子(NCAM-1)、再生相关蛋白(C-JUN)及髓鞘相关蛋白如髓鞘碱性蛋白(MBP)和髓鞘相关糖蛋白(MAG)。在面神经挤压伤模型中,C-Gel光照治疗显著改善FNI行为学评分,并通过降低ROS、HIF-1α与TNF-α水平减轻炎症反应。更重要的是,C-Gel促进施万细胞介导的髓鞘重塑,S100与NF200蛋白活化证实此过程。RNA测序揭示C-Gel光照上调PI3K-Akt和Ca2?信号通路。本研究提出了一种整合氧调控与免疫调节的新型生物材料策略,为推进面神经损伤修复治疗提供了新见解。
面神经(第七对脑神经)是最关键的脑神经之一,包含运动神经、感觉神经及副交感神经纤维。由于其解剖路径长且分布表浅,该神经极易因手术、创伤、感染及肿瘤受损。面神经损伤(FNI)常导致面瘫,引发显著容貌缺陷与心理困扰,严重影响患者生活质量。其独特的解剖特征与病理生理机制使FNI修复更为复杂,治疗难度远超其他脑神经损伤。
鉴于氧调控对施万细胞(SCs)功能与巨噬细胞极化的关键作用,作者提出:一种光响应性释氧生物材料或可为FNI修复提供创新解决方案。本研究开发的光响应性C-Gel水凝胶能实现时空可控供氧。通过整合体外体内实验,系统评估了C-Gel对施万细胞增殖、迁移、神经营养分泌及巨噬细胞极化的影响。进一步利用大鼠面神经挤压伤模型证实,C-Gel可加速神经功能恢复,并通过RNA测序阐明其分子机制。本研究提出的新型生物材料策略,通过协同氧调控与免疫调节应对FNI修复挑战,不仅深化了巨噬细胞-施万细胞互作机制认知,更为其他缺氧相关疾病提供了具潜力的治疗策略。研究设计示意图如下(Scheme 1)。
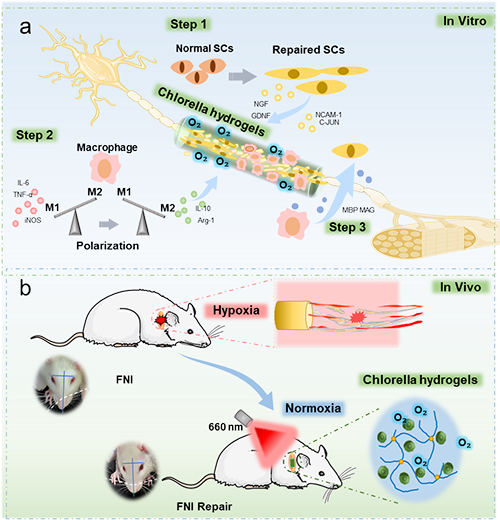
Scheme 1
1、C-Gel增殖与表征
小球藻在BG-11液体培养基与C-Gel中持续增殖17天(图1A)。第5、9天时,BG-11悬液(绿箭头)与C-Gel(粉箭头)中的藻细胞均处于增殖期(图1A)。第13-17天,液态/水凝胶体系中的藻细胞体积增大,色素体偏向分布(红箭头),此现象归因于代谢产物积累与营养耗竭引发的细胞衰老。值得注意的是,C-Gel组藻细胞密度(第5、9、13、17天粉箭头)显著高于BG-11组(图1B,1D)。C-Gel通过固定化封装藻细胞于凝胶基质(图1F),增强光照吸收与营养传输。扫描电镜证实C-Gel促进细胞黏附、营养输送及代谢废物清除,为藻细胞提供最优生长环境。
C-Gel释氧性能系统评估显示:在5×10? cells/mL藻密度下,660nm光照(2000 lx)4小时后达最高产氧率(16.773±0.472 mg/L)(图1E)。该材料具快速光响应性:同等藻密度下,30分钟光/暗循环即刻触发释氧(图1G)。连续光照8天仍维持稳定释氧(图1I),证实其持续光合活性。产氧速率可通过光照参数精准调控[24],与前期研究一致[21,25]。降解实验表明C-Gel于8日内逐渐崩解,14天后降解率>80%(图1C,1H),其可控降解特性与光响应释氧能力,完美适配需时序调控功能的生物医学应用。
流变学表征验证C-Gel结构稳定性:频率扫描(0.1-50 Hz, 1%应变)显示储能模量(G′)始终高于损耗模量(G″),证实凝胶以弹性主导(图1J)。相较于纯海藻酸盐水凝胶(Gel),掺入小球藻使G′微升,源于分子链缠结增强与聚合物网络强化[26]。应变扫描确定~10%临界应变点,超此值将引发不可逆结构破坏(图1K)。综上流变特性彰显C-Gel在生理应力下的卓越稳定性。该材料集光控释氧、可调降解与机械耐久性于一体,为神经组织修复中的缺氧难题提供精准解决方案。
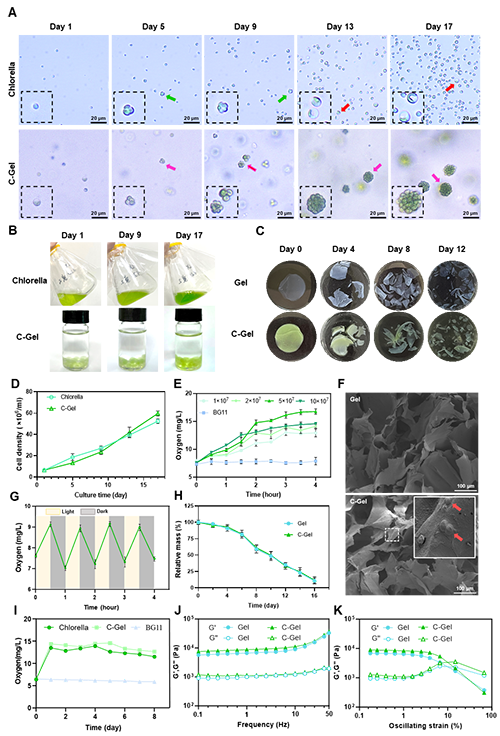
图1
2、面神经损伤(FNI)模型构建流程包括左侧神经分离、钳夹及C-Gel注射(图2A)。光疗组通过660nm光照(2000 lx,12小时/天)激活C-Gel释氧。实时溶氧监测证实光照8天持续维持>13.763±0.671 mg/L氧浓度(图1G,I)。该波长特异性氧调控机制此前已在缩小心肌梗死范围、促进乳腺癌细胞凋亡及加速糖尿病创面愈合中得到验证。行为学评分确认模型构建成功(图2C):术后FNI模型大鼠出现左侧面瘫特征,表现为睑裂闭合延迟、触须运动减弱及鼻尖向右偏斜(图2A),评分升至5分(对照组为0分)。第5-14天,C-Gel光疗组行为学评分显著优于FNI组与暗处理组,证实光控释氧促进神经修复(图2C)。第14天组织学显示:光疗组神经结构保存最完整,轴突完整性优于FNI组与暗处理组(图2D)。对照组神经纤维排列规整(图2E),FNI组出现髓鞘崩解(蓝箭头)及空泡变性(红箭头),暗处理组存在髓鞘溶解(蓝箭头)与无髓鞘轴突(红箭头)。光疗组虽部分轴轻微萎缩(红箭头),但纤维密度增高、髓鞘增厚且分布均匀(图2E)。
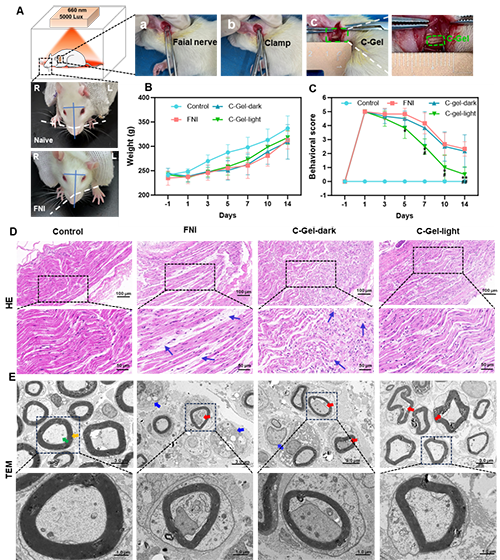
图2
本研究成功开发出具有优异生物相容性的光响应性释氧C-Gel水凝胶。该材料显著提升施万细胞(SCs)增殖能力与神经营养分泌功能,并有效调控巨噬细胞向M2型极化。体内实验进一步证实,C-Gel能促进面神经损伤(FNI)修复,并通过图示(Scheme 2)揭示其潜在分子机制。该策略为增强面神经损伤修复与再生提供了前景广阔的新途径。
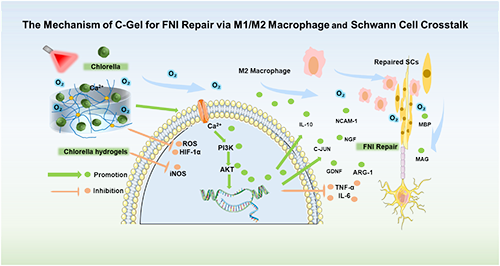
Scheme 2
研究获本研究得到四川省科技厅研究与发展计划重点项目(2022YFSY0046)、中央高校基本科研业务费项目(wgh2682023ZTPY065)和四川省中医药管理局项目(2020JC0127)的资助。
原文链接:https://doi.org/10.1002/adhm.202501123
魏桂花团队简介:
魏桂花老师团队主要靶向于神经病理性疼痛的治疗和神经损伤的修复,包括但不限于:
1.基于压电材料产生的电刺激对神经损伤修复、缓解神经病理性疼痛的作用及机制研究
2.基于生物信息学及体内实验探究中药复方缓解神经病理性疼痛的作用及机制
3.基于微藻可控产氧策略改善缺氧微环境促进神经损伤修复的作用及机制研究
