急性肺损伤(ALI)通常以呼吸窘迫、低氧血症和炎症的快速发作为特征,常由创伤、感染或全身性疾病引发。传统治疗方法主要依赖支持性护理如机械通气和氧疗,但这些方法存在局限性且无法精准作用于损伤部位。尽管药物治疗仍是ALI治疗的核心手段,但其临床应用常因副作用而受限。多酚类化合物因其抗氧化和抗炎特性备受关注,但其临床应用面临重大挑战,主要源于生物利用度低诸如口服吸收差、在胃肠道和肝脏中代谢迅速,导致体内有效浓度降低。此外,环境因素(如pH值、温度和酶解作用)易破坏多酚的稳定性,进一步削弱其疗效。高剂量多酚还可能引发肝毒性、肾毒性或与其他药物产生不良反应。因此,设计合适的靶向载体以改善多酚类药物的生物利用度与稳定性,对最大化其在ALI治疗中的潜力至关重要。
为突破上述限制,微纳米载药系统的开发成为研究焦点。传统微球制备技术(如溶剂挥发法、乳液聚合法)存在工艺缺陷如溶剂残留、粒径不均、载药效率低及突释效应明显。相比之下,电喷雾技术凭借精准电场调控可制备粒径均一、结构可控的载药微球,其低温加工特性尤其适用于热敏感药物。基于同轴电喷技术构建的核壳微球,不仅能通过孔隙率调控实现长达数周的缓释,还可利用表面功能化修饰(如纤连蛋白涂层)赋予病灶靶向能力,显著提升肺部药物蓄积效率。
近年来,针对ALI中巨噬细胞极化失衡的关键机制,研究揭示生物活性蛋白(如纤连蛋白FN)可通过整合素信号通路驱动M2型抗炎表型转化,与多酚类药物的抗氧化作用形成互补。这一发现为设计多功能纳米载体提供了重要启示:通过空间分隔负载不同活性成分(即核壳结构),这种载药方式既可避免分子间相互作用导致的失活,又能实现病灶部位的程序化释放。此外,有效调控以TNF-α、IL-1β、IL-6等促炎细胞因子过度分泌为特征的"细胞因子风暴",是炎症性疾病治疗的关键环节。这些细胞因子的过量产生会加剧炎症级联反应,可能导致多器官损伤或死亡。
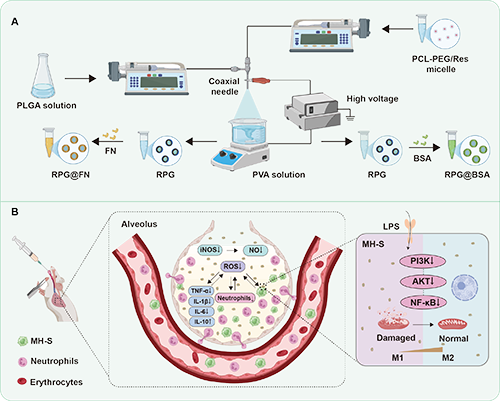
图1、RPG@FN微球的制备及其在ALI中的治疗机制示意图。

图2、(A)以芘为荧光探针测定的PCL-PEG胶束临界胶束浓度(CMC)。(B)游离Res、PCL-PEG/Res、RPG、RPG@BSA及RPG@FN的流体力学尺寸和(C)Zeta电位。(D)RPG@FN的扫描电镜(SEM)图像及(E)粒径分布直方图。(F)FN、RPG@FN、BSA、RPG@BSA和RPG的SDS-PAGE蛋白分析。(G)RPG@FN分散于水、PBS或含10%胎牛血清(FBS)的RPMI-1640培养基中不同时间段的流体力学尺寸变化。(H)RPG、RPG@BSA及RPG@FN在PBS中的Res累积释放曲线。(I)RPG、RPG@BSA和RPG@FN于37 °C PBS中持续8周的体外降解曲线。图(B)、(C)及(G-I)中实验重复3次(n=3),"ns"表示无统计学差异。

图3 (A)不同浓度Res、PCL-PEG/Res及RPG@FN处理MH-S细胞24小时的活力(n = 6)。(B)PBS、FN或RPG@FN处理MH-S细胞12小时后的荧光强度及(C)定量分析(n = 3)。(D)RGD预封闭处理对RPG@FN靶向MH-S细胞的荧光强度影响定量分析(n = 3);C-D图中FN经Cy5.5标记。(E)不同材料处理12小时后,DCFH-DA探针检测MH-S细胞活性氧(ROS)的荧光强度及(F)定量分析(n = 3)。(G)LPS激活的MH-S细胞与Res、FN、RPG@BSA或RPG@FN共孵育6小时,DCFH-DA染色后的共聚焦激光扫描显微镜(CLSM)图像(标尺:40 μm)。(H)JC-1荧光探针检测不同材料处理下MH-S细胞线粒体膜电位(MMP)的流式细胞术分析。C-D及F图中***表示p < 0.001。

图4、(A)不同处理组MH-S细胞CD86与CD206表达水平的流式细胞术分析。(B)CD206阳性与(C)CD86阳性巨噬细胞比例统计。(D)TNF-α、(E)IL-6、(F)IL-1β及(G)IL-10在细胞内的表达水平(24小时处理)。(H)细胞培养液中一氧化氮(NO)浓度检测。(I)蛋白质印迹(WB)分析不同处理组MH-S细胞中NF-κB与磷酸化Akt(p-Akt)的表达水平(I组:PBS;II组:LPS;III组:Res;IV组:FN;V组:RPG@BSA;VI组:RPG@FN)。图(B-H)中实验重复3次(n = 3),*表示p < 0.05,***表示p < 0.001。

图5、(A)ALI小鼠体内抗炎治疗示意图。(B)不同处理组ALI小鼠肺组织湿干重比。(C)各组小鼠肺组织中性粒细胞比例。(D)不同处理24小时后肺组织中性粒细胞流式细胞术点图。(E-H)支气管肺泡灌洗液(BALF)中促炎因子(TNF-α、IL-6、IL-1β)与抗炎因子(IL-10)水平检测。图(B-C)及(E-H)中实验重复3次(n = 3),**表示p < 0.01,***表示p < 0.001。

图6、(A)通过免疫荧光染色评估不同处理组ALI小鼠肺组织巨噬细胞极化状态(蓝色:DAPI核染色;绿色:M2型标记物Arg-1;红色:M1型标记物iNOS)。(B)各组ALI小鼠肺组织活性氧(ROS)清除效果(标尺:100 μm)。(C)肺组织H&E染色切片及(D)Micro-CT成像结果。图C中红色与黑色箭头分别指示肺泡壁充血及炎症细胞浸润区域(标尺:200 μm)。
简而言之,本研究采用同轴电喷技术开发了一种核壳结构微球递药系统(RPG@FN),用于ALI的高效治疗。该系统内核由负载Res的PCL-PEG胶束构成,外壳为PLGA材料,微球表面经FN物理修饰。通过系统表征RPG@FN的粒径形貌、稳定性、药物释放及降解性能,证实其结构完整性。体外实验验证了该体系在清除ROS、促进M2型巨噬细胞极化、恢复线粒体膜电位及调控炎症因子等方面的抗炎抗氧化活性。进一步通过ALI小鼠模型体内实验评估其治疗效果。RPG@FN微球的优势主要源于以下三点:(1)基于电喷技术构建的核壳微球以载药胶束为内核,可实现肺部长效缓释;(2)显著提升Res与FN的生物利用度,避免其降解失活;(3)FN修饰赋予微球炎症巨噬细胞靶向性,通过ROS清除与M2极化双重机制,协同恢复线粒体稳态并阻断NF-κB/PI3K-Akt信号通路。
文章链接:https://doi.org/10.1016/j.jcis.2025.01.249
- 我国发明黏稠物快速检测新方法 2009-11-10
- 蛋白质非共价复合物的电喷雾质谱(ESI-MS)研究 2004-06-02
- 华东理工刘润辉教授课题组《Nat. Biotechnol.》:基于宿主防御肽模拟物组装体的共递送组合体内协同治疗耐药真菌感染 2026-01-02
- 浙江大学周民团队《Cell》子刊:“药食同源”微藻-黄芪多糖系统减少免疫治疗不良事件并增强疗效 2025-08-26
- 东华大学沈明武研究员/史向阳教授团队:铜掺杂层状双金属氢氧化物共递送蛋白/药物调控肿瘤双重代谢实现级联的化学动力学/免疫治疗 2025-02-08
- 东华大学史向阳教授团队 BAM:具有自身生物活性的羟基化含磷树状大分子脑内递送纤连蛋白协同调节小胶质细胞实现帕金森病的增强治疗 2024-04-26
- 东华大学史向阳教授团队《ACS Nano》:纤连蛋白包覆的含磷树状大分子纳米颗粒通过多重调节骨微环境增强骨关节炎治疗 2024-04-05
