线粒体DNA(mtDNA)作为内源性激动剂,由于缺少丰富的组蛋白保护,容易在应激下受损,从而导致mtDNA片段通过多种途径被进一步释放到肿瘤微环境(TME)中,成为激活环磷酸鸟苷-腺苷合成酶(cGAS-STING)通路的关键触发因素。因此,研究设想通过治疗手段加剧mtDNA损伤,促进肿瘤来源的mtDNA释放到TME中介导cGAS-STING信号依赖的免疫激活。
光动力疗法(PDT)是利用特定波长的光激发光敏剂实现电子跃迁以产生大量的活性氧(ROS),通过共同修饰线粒体靶向基团和光敏剂在两亲性聚乙二醇上,可以精确地在线粒体内实现mtDNA损伤。同时进一步将呋喃结构引入线粒体靶向基团、光敏剂修饰的材料,可联合极具细胞毒性的DNA链间交联(ICLs)策略共同加剧mtDNA损伤。该结构可确保呋喃部分被线粒体靶向PDT产生的ROS原位氧化为活性二羰基结构,进而与mtDNA快速高效地发生化学交联。同时,课题组在前期基于TME响应型锰离子(Mn2+)-多酚纳米材料的工作中已证实多酚鳌合递送Mn2+可强效显著增强双链DNA(dsDNA)与cGAS的结合活性,敏化cGAS-STING信号通路。因此,将多酚结构引入上述多功能基团修饰的聚合物中有望联合Mn2+和mtDNA片段,通过在TME中强效激活cGAS-STING通路的重塑TME,增强抗肿瘤免疫反应。
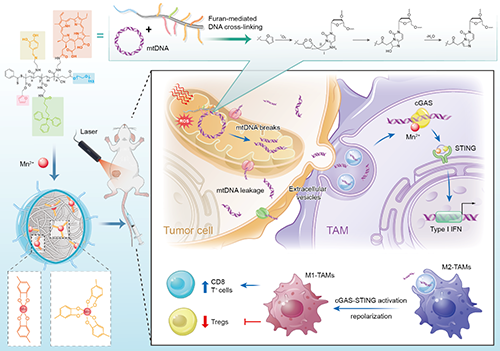
图1. 金属多酚纳米材料的组成,通过光诱导的氧化损伤与DNA交联损伤的协同效应,促进更多的mtDNA片段从线粒体中释放,以cGAS-STING依赖的方式促进M2型巨噬细胞向M1型的极化并启动抗肿瘤免疫反应。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202411498
- 波尔多大学Gilles Sèbe、华南师大张振 Carbohydrate Polymers:皮克林乳液界面SI-ATRP制备两亲性纤维素纳米晶 2025-05-19
- 东华大学武培怡/焦玉聪团队 Angew: α-甲基调控两亲性聚离子液体助力锌碘电池 2025-03-18
- 复旦聂志鸿/黄霞芸 Soft Matter:基于两亲性聚电解质的Janus太阳能海水淡化策略 2025-02-26
- 西工大李鹏、贾庆岩 Sci. Bull.:多酚聚合物细胞膜涂层“包覆”肿瘤实现代谢物递送抑制治疗 2024-02-18
- 澳门大学代云路课题组《Adv. Sci.》:自降解纳米凝胶通过药物再利用策略重塑肿瘤微环境以重新激活CD8? T细胞 2023-05-11
- “化敌为友”:澳门大学代云路团队研发焦亡型放疗药物 2023-03-20
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
