冻干是市面上一种常见的保存新鲜蔬果的方式,通过先低温后真空的处理方法将蔬果内的水分由冰直接升华成水蒸气,从而实现脱水保鲜的效果。冻干技术可以维持住食物的色香味,并能将食品内大部分的营养物质保留下来,获得不少消费者的喜爱。那么人们是否也可以冻干一些肌体组织,保持其内部的有效成分和结构,作为一种活性材料充分发挥其自身的特性,并用于生物医药领域呢?
CAR T疗法在血液肿瘤治疗中已取得突破性进展,但是对于实体瘤的疗效仍十分有限。致密的肿瘤外基质会导致CAR T细胞浸润不佳,抑制性的肿瘤微环境也会造成CAR T细胞的失能和耗竭。
、

淋巴结是人体内非常重要的免疫器官。其内部特殊的天然结构适合T细胞生存、训练、复制。多种营养物质与生长调节因子在血液中通过高内皮静脉进入淋巴结,从而为免疫细胞的活化和成熟提供支持。淋巴结内的成纤维网状细胞以及其他基质细胞组成结构支撑的同时也会分泌趋化因子等物质来促进免疫细胞的招募与存活。
临床上,外科医生在手术切除肿瘤前,通常会将病人肿瘤附近的淋巴结清扫出来,作为预后判断是否发生转移的依据。研究团队通过冻干技术保留住淋巴结内的关键成分和多孔基质结构,从而装载递送可以特异识别清除肿瘤的CAR T细胞。
冻干后,淋巴结产生疏松多孔的结构可以容纳T细胞。同时冻干后的淋巴结由于除去水分,吸水性增强。CAR T细胞悬液可以轻松地被吸入淋巴结内部。载药的冻干淋巴结可以填埋回肿瘤术后切除的空腔部位,作为一个CAR T细胞储库,持续释放药物,以清除局部残留的微小肿瘤,抑制术后复发。
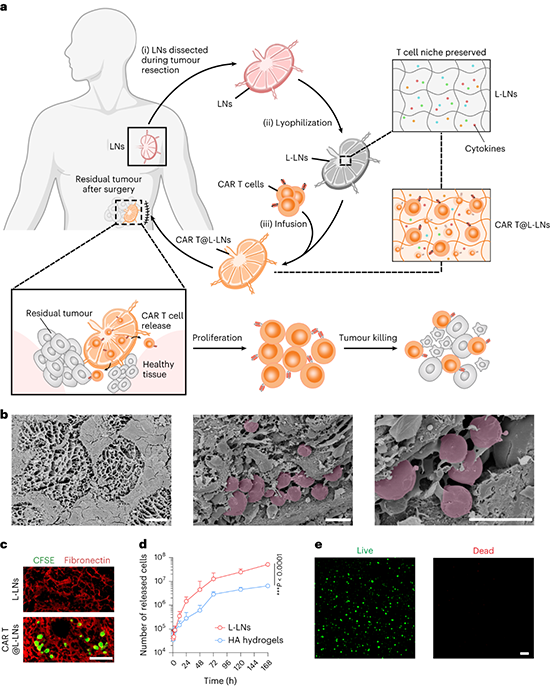
载CAR T的冻干淋巴结的示意图与相关表征
对比装载在人工合成的透明质酸凝胶载体,装载在冻干淋巴结内的CAR T细胞在与肿瘤细胞共培养3天后,扩增效率可达3.5倍的提升。与肿瘤细胞共培养7天后,冻干淋巴结的实验组可以使T细胞分化出更多的记忆表型,预示了使用冻干淋巴结载体可以让CAR T疗法更强效持久。
进一步的动物水平研究也证实冻干淋巴结对CAR T具有强大的增效能力,在包括人源肿瘤细胞系和病人肿瘤组织来源的肿瘤模型中,冻干淋巴结装载CAR T细胞治疗后所表现的抑瘤效果、瘤内活化的CAR T细胞数量以及杀伤因子的产生量均显著优于相同剂量CAR T装载于人工合成的透明质酸凝胶载体。
淋巴结材料本身取材于病人自体,对比起人工合成的透明质酸凝胶,埋置回体内的冻干淋巴结不会诱发强烈的炎症反应。
原文链接:https://www.nature.com/articles/s41563-024-01825-z
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 南开大学余志林课题组 JACS:开发了首例活细胞内耗散组装体系 2023-12-20
- 西安交大徐光魁教授、清华冯西桥教授课题组 JMPS: 活性软组织的动态高阶失稳与自发恢复 2023-11-26
- 复旦陈国颂教授、上海交大崔文国教授《Adv. Mater.》:构建活性生物材料 - 操控鲑鱼降钙素的组装体形貌并提升其骨修复效果 2022-09-20
