唐本忠院士深大团队王东教授、浙大计剑教授 Adv. Mater.:光触发级联疗法 - NIR-II AIE分子联合NO促进胶原降解,增强胰腺癌光诊疗
2024-01-04 来源:高分子科技
胰腺癌是最具侵袭性的恶性肿瘤之一,其5年总生存率低于10%,具有起病隐匿、早期诊断困难、转移快、预后差的特点。多数胰腺癌患者一旦确诊就失去手术指征,局限于放疗/化疗。一些一线化疗药物,如吉西他滨和白蛋白结合型紫杉醇,已广泛用于临床治疗胰腺癌。与游离化疗药物相比,载体组装的纳米药物可以通过增强渗透与滞留效应(EPR)优先在肿瘤中积累,从而提高稳定性和可控性释放,减少副作用。然而,纳米药物主导的化疗方案对改善患者整体预后的作用有限,这主要归因于胰腺癌独特的肿瘤微环境,其肿瘤组织中致密的细胞外基质(ECM)严重阻碍了纳米药物的渗透,导致治疗效果不佳。

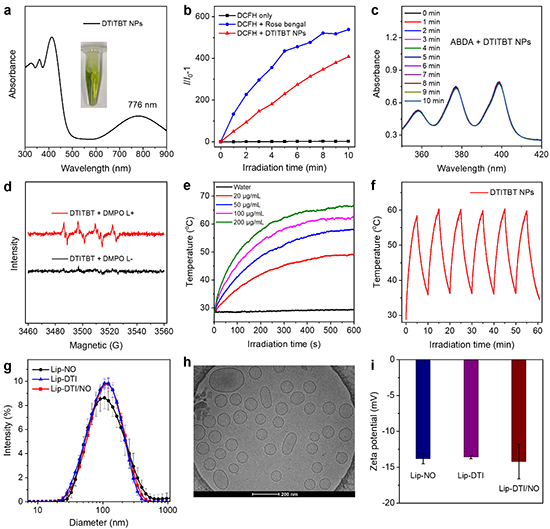
图2 DTITBT纳米粒子的光物理性质及光动力、光热性质表征和脂质体的表征。
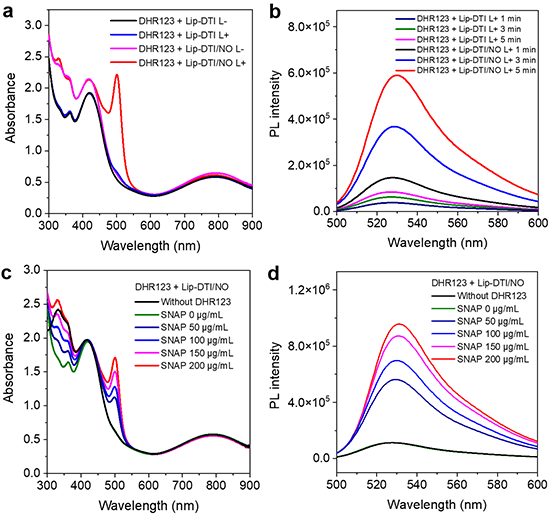
图3 脂质体在溶液中产生ONOO-的评估。
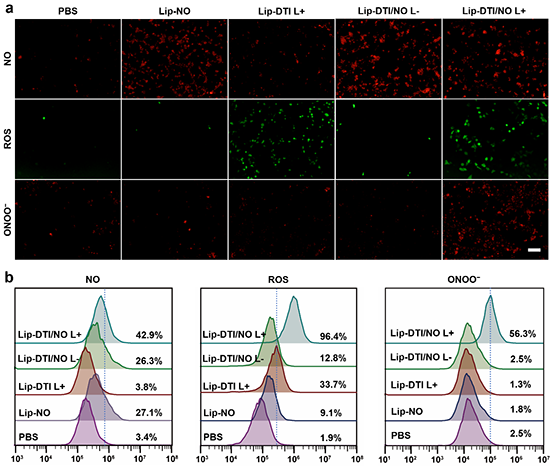
图4 细胞内产生NO、ROS和ONOO-的评价。

图5 经不同治疗后肿瘤组织中ONOO-,MMPs和胶原耗竭的评价。
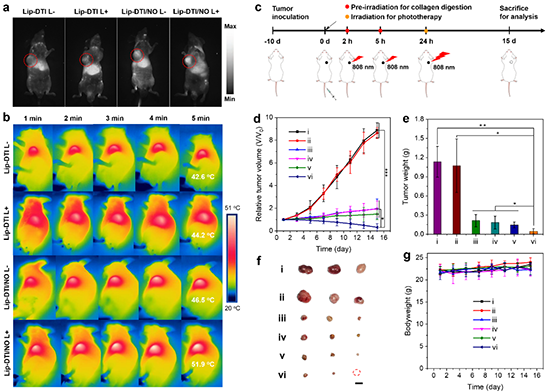
图6 活体荧光和光热成像及皮下NIH3T3/PANC-1荷瘤小鼠抑瘤实验。
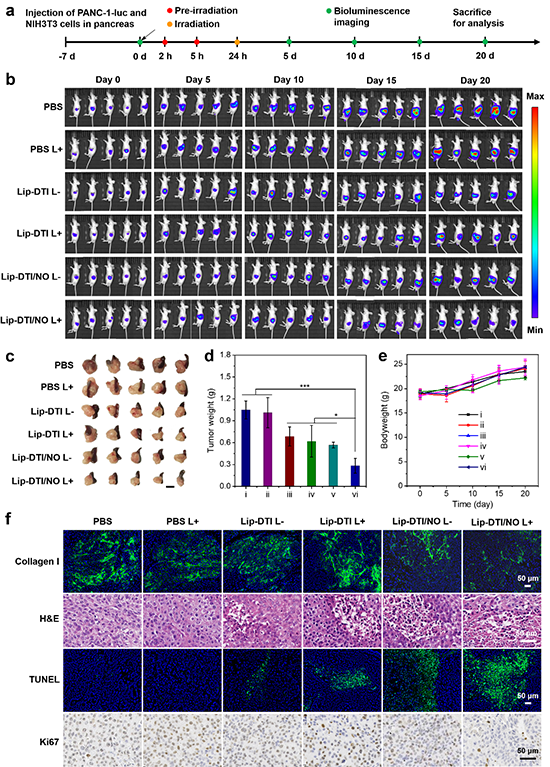
图7 原位NIH3T3/PANC-1荷瘤小鼠抑瘤实验。
论文信息:Dan Li, Xiaohui Chen, Wenbin Dai, Qiao Jin, Dong Wang*, Jian Ji*, Ben Zhong Tang*. Photo-Triggered Cascade Therapy: A NIR-II AIE Luminogen Collaborating with Nitric Oxide Facilitates Efficient Collagen Depletion for Boosting Pancreatic Cancer Phototheranostics. Adv. Mater., 2023,DOI: 10.1002/adma.202306476.
原文链接:http://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202306476
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 西北大学范代娣教授、朱晨辉教授、李阳副教授 AM:基于仿生凝血级联途径的多肽修饰脂质体纳米颗粒可喷涂水凝胶治疗不可压破性创面出血 2025-04-19
- 天津大学史志远教授团队招聘科研助理 - 高分子化学、微凝胶/微囊泡/脂质体、酶包裹递送载体、微流控 2024-12-17
- 桂工甄士杰/李美静博士、广医张天富副教授、华工赵祖金教授、港中深唐本忠院士 AM:近红外二区脂质体多模态光诊疗新成果 2024-11-29
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 港中大(深圳)赵征 / 唐本忠团队 ACS Nano :多功能AIE纳米马达突破肿瘤屏障 - 实现精准光诊疗 2025-05-29
