癌症是全世界公认的健康问题之一。尽管临床中应用于癌症治疗的技术在不断进步,但传统的治疗手段依然难以解决治疗过程中肿瘤易转移、化疗药物靶向性差且容易产生耐药性等问题。为了解决这些难题,许多新的癌症治疗方式应运而生,如:基因治疗、光动力治疗、光热治疗、免疫治疗等。其中光热治疗(PTT, photothermal therapy)作为一种肿瘤光学治疗新策略,通过将光能转化为热能,可以有针对性地在局部杀死癌细胞,在恶性肿瘤治疗方面具有微创、长效、安全等特点,从而受到广泛关注。此外,光照过程中产生的热量不仅可以杀伤肿瘤细胞,还可以作为药物释放的开关,从而实现化疗药物的定点释放,具有良好的时空响应特性。然而,使用光热治疗仍然存在病灶部位残留微小肿瘤以及较难抑制转移肿瘤等问题。
在生理温和条件下进行高效的化学反应在生物医学领域展现出广阔的前景。近来,越来越多的研究者们将目光聚焦到利用高效的化学反应干扰或阻断生物大分子的生理功能,从而实现癌症治疗的目的。值得注意的是,由化学反应引起的生物大分子功能的破坏可能会诱发肿瘤细胞产生免疫原性死亡(ICD, immunogenic cell death),从而激活机体的先天和适应性免疫反应,进一步实现肿瘤杀伤。然而,在实际应用过程中,精确控制反应的效率、位置和持续时间是非常困难的,这严重限制了将化学反应应用于癌症治疗中。
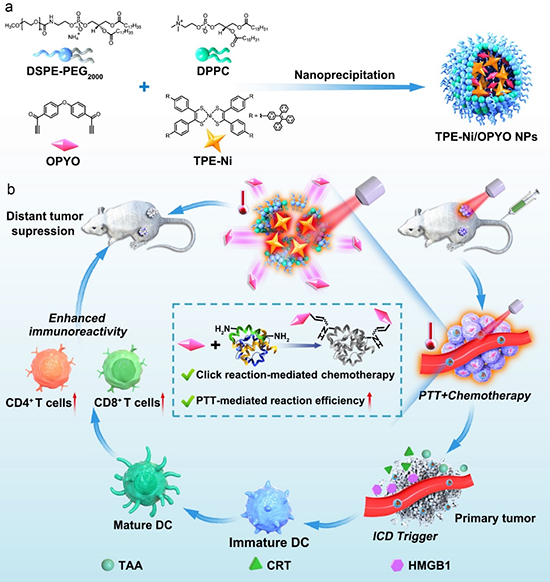
图1 近红外光热响应纳米粒子的制备和点击反应介导的化疗联合光热治疗实现高效肿瘤抑制示意图。
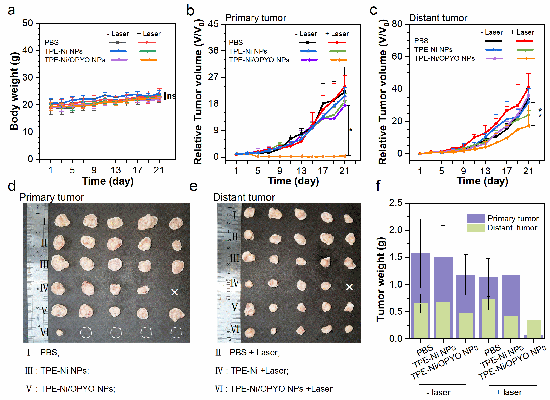
作者进一步在活体层面验证了这一策略的可行性(图3)。利用点击反应介导的化疗联合光热治疗,在保证良好生物安全性的条件下,成功实现了小鼠原发肿瘤的消融,并有效抑制了远端肿瘤的生长。其治疗效果显著优于单独使用光热治疗组。
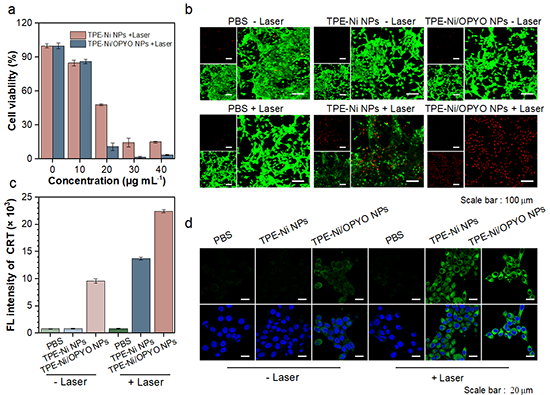
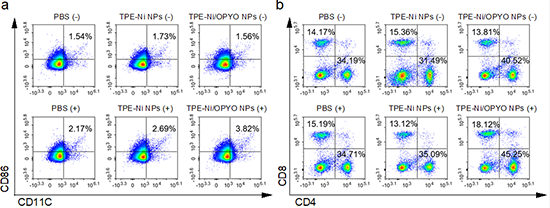
研究表明,由TPE-Ni/OPYO NPs介导的协同治疗可通过促进DC细胞的成熟和CD3+CD4+ T细胞的增殖来提升对于肿瘤的杀伤能力,从而实现有效的原发肿瘤的消融和远端肿瘤的生长抑制(图4)。
该工作是该团队近期利用点击反应实现恶性肿瘤消融的最新进展之一。通过将高效的点击反应和光热治疗相结合,在近红外光照射下,实现了活化炔在肿瘤部位的定点释放,并且可以进一步增强免疫原性细胞死亡,实现肿瘤的高效消融,为肿瘤治疗提供了新的思路。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.3c03005
- 吕超教授/田锐副教授《Nat. Commun.》:共价点击反应制备高机械强度室温磷光材料 2023-08-08
- 福州大学赖跃坤教授团队《Adv. Mater.》:点击反应快速制备柔性多功能类液体防污涂层新策略 2022-09-09
- 杭州医学院黄东胜教授/东方肝胆杨田教授 AM:基于触发点击反应的响应性水凝胶合成及在肝癌治疗中的应用 2022-05-20
- 北化徐福建/赵娜娜/申鹤云《ACS Nano》:两亲性聚氨基酸纳米佐剂介导的光热增强免疫治疗 2024-11-13
- 西南交大杨光副研究员/周绍兵教授团队《Adv. Mater.》:一种用于重塑肿瘤酸性微环境以增强免疫治疗的多级结构纤维装置 2023-03-27
- 中山大学吴玫颖/中国医学科学院生物医学工程研究所梅林 Adv. Sci.:聚吡咯纳米酶调控肿瘤相关巨噬细胞极化以增强免疫治疗 2022-06-23
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
