西南交大鲁雄/中国海大韩璐/北京基础医学研究所江小霞等Nano Today:导电粘附水凝胶调控创伤性脑损伤后的神经炎症与神经功能
2023-07-23 来源:高分子科技
创伤性脑损伤(Traumatic brain injury, TBI)具有病情急、变化快、病死率高、致残率高、预后差等特点,严重危害人类生命健康。由机械损伤造成的原发性损伤易诱发包括氧化应激、神经炎症、细胞凋亡、神经退化等继发性损伤,进而导致脑神经功能障碍。此外,TBI会导致脑组织细胞外基质的缺失,由于缺少物理支撑,神经元无法浸入病灶部位,进而诱发脑肿胀/萎缩并加重疾病进展。目前脑损伤的临床治疗大多使用阿司匹林等非甾体类抗炎药物或者激素类药物以减轻炎症反应,但由于毒副作用大,不适于长期服用。鉴于其复杂的发病机制及病理特征, TBI有效的临床治疗仍是难题。因此,亟需开发一种新的治疗策略以防止脑损伤后的二次伤害,并加速脑神经再生。

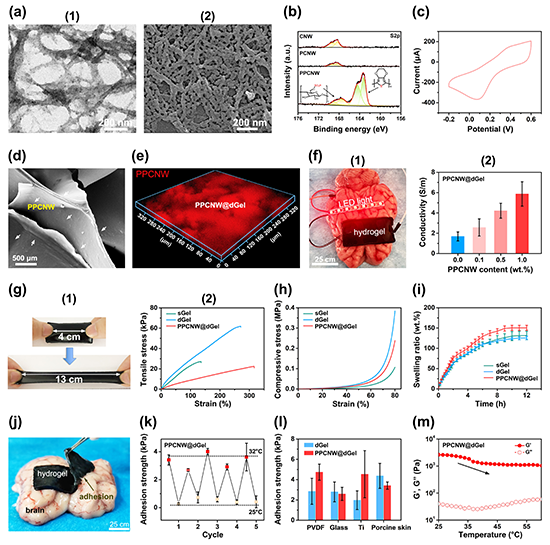


图4. PPCNW@dGel水凝胶在电刺激下促进HT22神经元细胞增殖、铺展及分化。

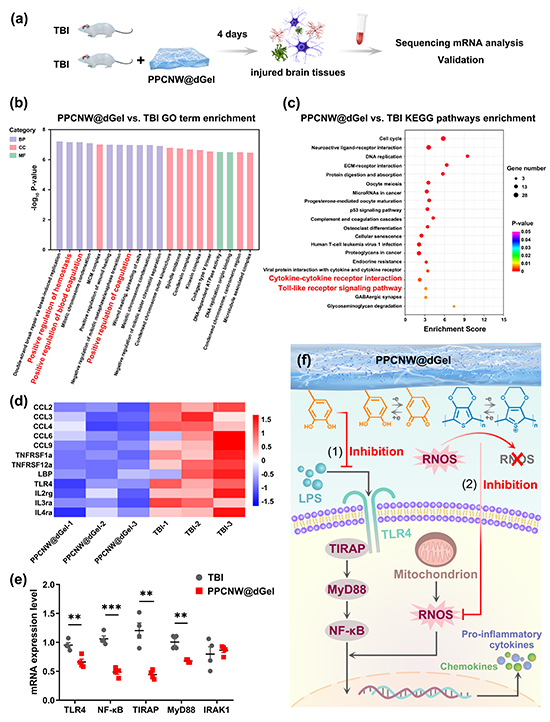

图7. PPCNW@dGel水凝胶促进体内神经再生及功能恢复。PPCNW@dGel水凝胶可以保护海马体神经元并促进其再生,进而提高TBI小鼠的记忆、认知及学习能力。
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S1748013223001834
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
- 浙大郑强/太原理工朱凤博团队 CEJ:碱激发粉煤灰催化的强韧复合水凝胶的可持续与规模化制备及其应用 2026-02-28
- UCLA 贺曦敏教授团队 Adv. Mater.:从“链段运动”入手 - 一种刷新各向同性纪录的超强韧PVA水凝胶 2026-02-26
- 西南大学曾建兵《Macromolecules》:聚多巴胺辅助构建高性能室温自修复导电弹性体 2025-10-19
- 新疆大学吐尔逊·阿不都热依木教授团队 CEJ: 聚多巴胺-PEDOT基便携式传感器用于氯丙嗪和诺氟沙星的同步测定 2025-09-05
- 新疆大学吐尔逊·阿不都热依木教授团队 AFM:利用3D Ti3C2Tx 混合电极材料增强电化学储能 2025-07-31
- 吉林大学徐雁教授/法国科学院 Yoshiharu Nishiyama教授《ACS Nano》:首次实现纤维素纳米晶右旋光子薄膜 2025-12-19
