武汉大学张先正教授团队《Adv. Mater.》: 吸入型荚膜多糖包裹的镓多酚纳米粒子通过清除肺部菌群增强肺癌化疗效果
2023-06-15 来源:高分子科技
肺癌是全球发病率和死亡率最高的癌症之一,其五年生存率不足19%。化疗是肺癌的主要治疗方式,特别是对于小细胞肺癌患者。然而,不同肺癌患者对化疗的应答率差异很大,并且几乎所有患者最终都会产生化疗耐药。诸多证据表明,宿主共生菌群,更确切地说,微生物群及其代谢产物的生理活动与肿瘤化疗疗效密切相关。这些共生微生物通过诱导癌细胞自噬、免疫抑制、药物降解等方式促进肿瘤化疗耐药。然而,目前该领域的研究主要集中在探究胃肠道共生菌群对化疗疗效的影响,而关于肺部菌群对化疗干预机制的相关研究还十分有限。由于肺部粘膜与外界环境直接相通,肺组织定植有大量的微生物群。因此,揭示肺部菌群在肺癌化疗中扮演的角色是提高肺癌化疗效果的重要方向之一。

图1 雾化荚膜多糖包裹的镓多酚纳米药物通过清除肺部菌群增强肺癌化疗效果
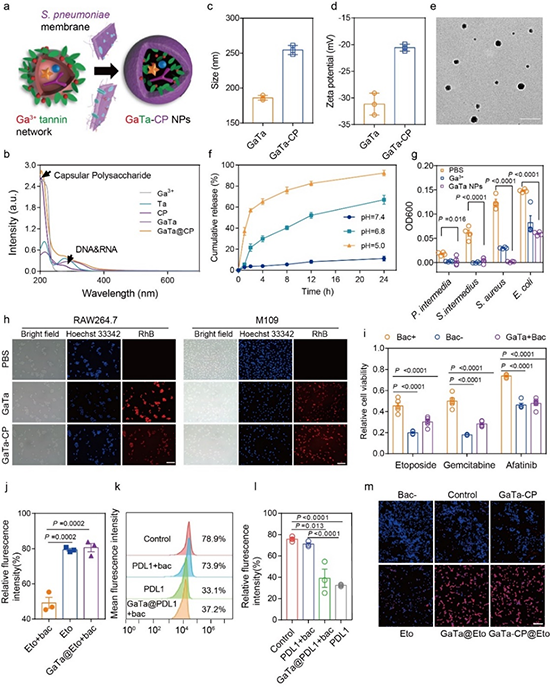
图2 GaTa-CP@Eto NPs在细胞层面上增强对肺癌细胞的毒性

图3 雾化GaTa-CP@Eto NPs通过清除肺部菌群增强化疗效果
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202302551
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 浙江大学周民团队《Cell》子刊:“药食同源”微藻-黄芪多糖系统减少免疫治疗不良事件并增强疗效 2025-08-26
- 广西大学林宝凤教授团队 Carbohyd. Polym.: 基于天然多糖的绿色低温缓冲包装材料的研究 2025-07-23
- 兰州理工大学牛小慧/王坤杰团队 ACS Nano: 内含界面电场的手性多糖水凝胶材料 2025-07-14
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 浙江大学高长有团队 Prog. Mater. Sci.:用于组织修复的自适应性生物材料 2025-11-30
