目前,同步裂解回路策略与物理封装技术均可有效控制细菌数量和行为,提高存活和定植效率,并有效控制工程菌裂解和胞内货物释放。口服蛋白疫苗具有安全性高、依从性强等优势,临床上主要用于预防肠道病原体感染。然而,由于胃肠道转运(GIT)过程中存在各种酶和胃部酸性pH,口服蛋白疫苗的生物活性大大降低,限制了其治疗效果。
针对这一问题,天津大学王汉杰教授和刘培源设计了一种可编程的口服工程菌水凝胶,用于肠道原位生产和释放肿瘤纳米疫苗,为口服蛋白疫苗的应用提供一种新方法。研究成果A Programmable Oral Bacterial Hydrogel for Controllable Production and Release of Nanovaccine for Tumor Immunotherapy发表在Biomaterials期刊。
在本研究中,研究团队利用合成生物学技术构建了一种群感裂解释放纳米疫苗的工程菌,并通过海藻酸钠/壳聚糖水凝胶进行包裹,在GIT过程中为工程菌提供时空保护,提高存活率。口服工程菌水凝胶在肠道环境下发生崩解,释放的工程菌内部表达纳米疫苗。在合成生物同步裂解电路的时空控制下,纳米疫苗从工程菌中释放出来,激活肠道粘膜免疫,进而激活全身免疫。以皮下结直肠癌模型为例,探究了纳米疫苗的免疫激活效果。

研究内容:
(1)为了提高口服工程菌的递送效率,本研究将工程菌与海藻酸钠溶液共混,利用注射泵匀速挤出,在氯化钙溶液中固化形成微球,微球的大小可通过注射泵流速控制。随后,在其表面包覆一层壳聚糖,制备的B@SC水凝胶微球具有很好的包封性能,可有效保护工程菌在胃模拟液的活性,并实现其在肠模拟液中的有效释放。

图1:口服工程菌水凝胶的制备与表征
(2)为了实现纳米疫苗的生产与释放,本研究以细菌微室(BMC)为骨架,在其表面展示AH1-A5抗原。在群感裂解回路(SLC)的控制下,工程菌发生周期性震荡裂解,实现纳米疫苗(BMC-AH1-A5)的累积释放。

图2:工程菌生产与释放纳米疫苗的表征
(3)为了验证释放的纳米疫苗的免疫激活作用,本研究利用体外和体内实验探究了免疫细胞的激活效果。与BMC相比,BMC-AH1-A5纳米疫苗可有效激活抗原提呈细胞,并进一步激活CD4+T和CD8+T细胞,从而杀伤肿瘤细胞。

图3:纳米疫苗的体外和体内免疫激活作用研究
(4)通过构建皮下肿瘤模型,验证口服工程菌水凝胶的肠道粘膜免疫激活效果。口服工程菌水凝胶可在体生产并释放BMC-AH1-A5纳米疫苗,激活肠系膜淋巴结中的CD4+T和CD8+T细胞,从而抑制皮下肿瘤生长。

图4:口服工程菌水凝胶抑制皮下肿瘤生长
(5)进一步验证了口服工程菌水凝胶的全身免疫激活效果。BMC-AH1-A5纳米疫苗有效激活脾脏中的免疫细胞,并促进相关免疫因子生成。
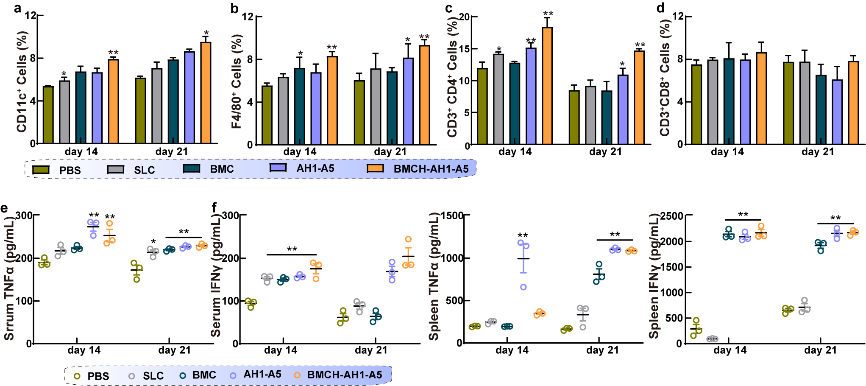
图5:口服工程菌水凝胶激活获得性免疫作用
综上,这项工作将材料学与合成生物学相结合,构建了一种可编程口服工程菌水凝胶,为口服蛋白疫苗的生物医学应用提供了新思路。论文第一作者为徐州医科大学医学影像学院张英英副教授和天津大学生命科学学院硕士研究生康如如,天津大学生命科学学院王汉杰教授和刘培源为该文章的共同通讯作者。该研究工作获得国家重点研发计划“合成生物学”专项、国家自然科学基金委员会优秀青年科学基金项目、面上项目、江苏省自然科学基金等经费资助。
参考文献:1. Zhang Y, Kang R, Zhang X, Pang G, Li L, Han C, Liu B, Xue X, Liu J, Sun T, Wang T, Liu P, Wang H. A programmable oral bacterial hydrogel for controllable production and release of nanovaccine for tumor immunotherapy. Biomaterials. 2023, 299:122147.
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0142961223001552
- 南京理工傅佳骏/姚博文团队 Nat. Commun.:类神经、导电通路可重构的水凝胶基一体化电子电路用于人-机整合 2026-02-14
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 南京大学王炜/曹毅/薛斌团队 Nat. Commun.:仿生分级picot纤维水凝胶涂层实现超低摩擦与高耐磨性 2026-02-09
- 华东理工刘润辉教授、叶邦策教授 AHM:新型口服递送系统包封智能工程菌用于炎症性肠病治疗 2024-12-20
- 上海交大刘尽尧团队 Sci. Adv.:表面修饰赋能光活性基因工程菌 2024-03-10
- 上海交大刘尽尧团队Adv. Mater.:工程菌介导的瘤内时空可控药物分布 2021-11-07
