实体肿瘤内因有限的血管分布、致密的细胞外基质以及弱酸性环境等不利因素,导致抗肿瘤药物在瘤内的富集和滞留效率低下。纳米载体能显著增强抗肿瘤药物的溶解性和血液循环时间,以及具有改善药物体内分布等优势。然而,据统计仅有0.7%左右的纳米药物能被有效递送至肿瘤部位,虽然在降低药物毒副作用等方面得到了改良,但如何大幅度提高纳米药物在肿瘤病灶的富集和滞留仍然面临挑战。
与药物分子和纳米颗粒不同,细菌可以活跃地游离血管系统并深入肿瘤组织深处,并且能借助肿瘤组织的乏氧区域以及免疫抑制环境长期定植于肿瘤内部。因此,细菌为瘤内药物递送及滞留提供了机遇。基于此,上海交通大学刘尽尧团队报道了基于工程菌的实体瘤内联合药物的时空可控分布,可重编程免疫抑制微环境以优化抗肿瘤功效。
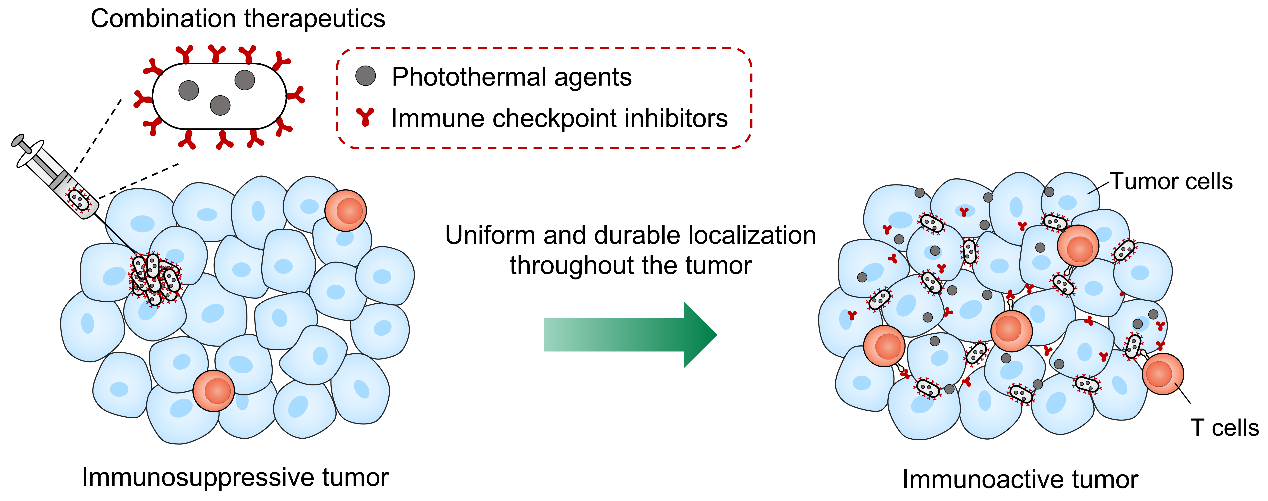
研究人员通过联合基因工程和高分子化学手段,同时对细菌内外进行修饰,使细菌胞内负载光热黑色素分子的同时表面通过多巴胺原位聚合锚定免疫检查点抑制剂PD-1抗体。由于能够充分定植于缺氧的瘤内环境中,细菌在离体肿瘤组织和小鼠在体肿瘤内均实现了光热试剂和 PD-1 抗体均匀且持久的分布。值得一提的是,黑色素的时空可控分布提供了较长的治疗窗口期,可通过激光辐照重复产生适度且均匀的热量,以诱导强有力的热触发抗肿瘤免疫。与瘤内分布均匀且滞留持久的PD-1抗体相结合,双重修饰的细菌可实现双重免疫激活效应,协同重编程肿瘤免疫微环境。研究人员在小鼠皮下和原位乳腺癌模型中证明了这种方法的治疗潜力,在抑制肿瘤生长和延长存活期方面均具有显著优势。该工作揭示了治疗药物如何以时空可控的方式分布于肿瘤中,并提出了双重修饰细菌在肿瘤联合治疗中的应用策略。

上海交通大学医学院分子医学研究院博士后王露,助理研究员曹浈萍为该论文共同第一作者,刘尽尧研究员为通讯作者。该工作得到第十四批国家海外高层次人才引进青年项目、科技部重点研发计划课题、国家自然科学基金委面上项目等支持。

论文链接:https://doi.org/10.1002/adma.202106669
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 苏大附一院朱雪松/张一健/蒋定华、华东理工袁媛 BAM:“内外兼修”的基因工程水凝胶加速衰老骨修复 2025-05-26
- 纽约州立大学宾汉姆顿分校饶思圆课题组诚招博士、硕士研究生 - 化学、材料学、生物工程、电子工程、神经科学、基因工程 2025-04-11
- 上海交大刘尽尧团队 Sci. Adv.:表面修饰赋能光活性基因工程菌 2024-03-10
- 西安交通大学绿色化工与新材料研究院高分子化工新材料创新中心诚聘青年优秀教师和博士后 2026-01-09
