肿瘤免疫疗法是一种革命性的疗法,可以激活患者固有的免疫系统来识别和攻击癌细胞。然而,尽管免疫疗法在多种类型的肿瘤患者中取得了显着的成功,但临床反应率低和治疗相关的不良反应仍然存在挑战。水凝胶具有作为局部免疫壁龛的潜力,可以通过调节肿瘤微环境 (TME) 来刺激免疫系统并提高免疫治疗效果。此外,具有类酶催化效应的纳米酶的发展为调节 TME 提供了新的思路。
针对肿瘤免疫疗法的副作用,西南交通大学鲁雄教授、谢超鸣副教授团队和苏州大学汪超教授团队联合开发了一种基于多酚修饰的碳量子点为支撑的钯单原子纳米酶(DA-CQD@Pd SAN),并利用DA-CQD@Pd SAN制备了一种生物粘附水凝胶,用于局部免疫调节和纳米酶催化肿瘤免疫治疗。在目标肿瘤部位原位注射生物粘附水凝胶以触发纳米酶诱导的免疫原性细胞死亡,提供免疫佐剂的局部递送,并调控局部免疫细胞行为,从而放大免疫治疗效果。
本文要点:
DA-CQD@Pd SAN由于具有双重催化机制,从而显示出很高的催化活性。
-
(1) DA-CQD@Pd SAN催化过硫酸铵产生自由基诱导水凝胶原位自固化;
-
(2) 通过消耗肿瘤内部H2O2产生大量ROS杀死局部肿瘤;
-
(3)DA-CQD@Pd SAN上的邻苯二酚结构赋予水凝胶粘附性能;
-
(4)水凝胶局部缓释免疫佐剂CpG ODN,减少其毒性的影响;
-
(5)DA-CQD@Pd SAN的催化动力、CpG ODN和免疫检查点抑制剂(anti-PD-L1)的免疫疗法协同防止肿瘤转移和复发。
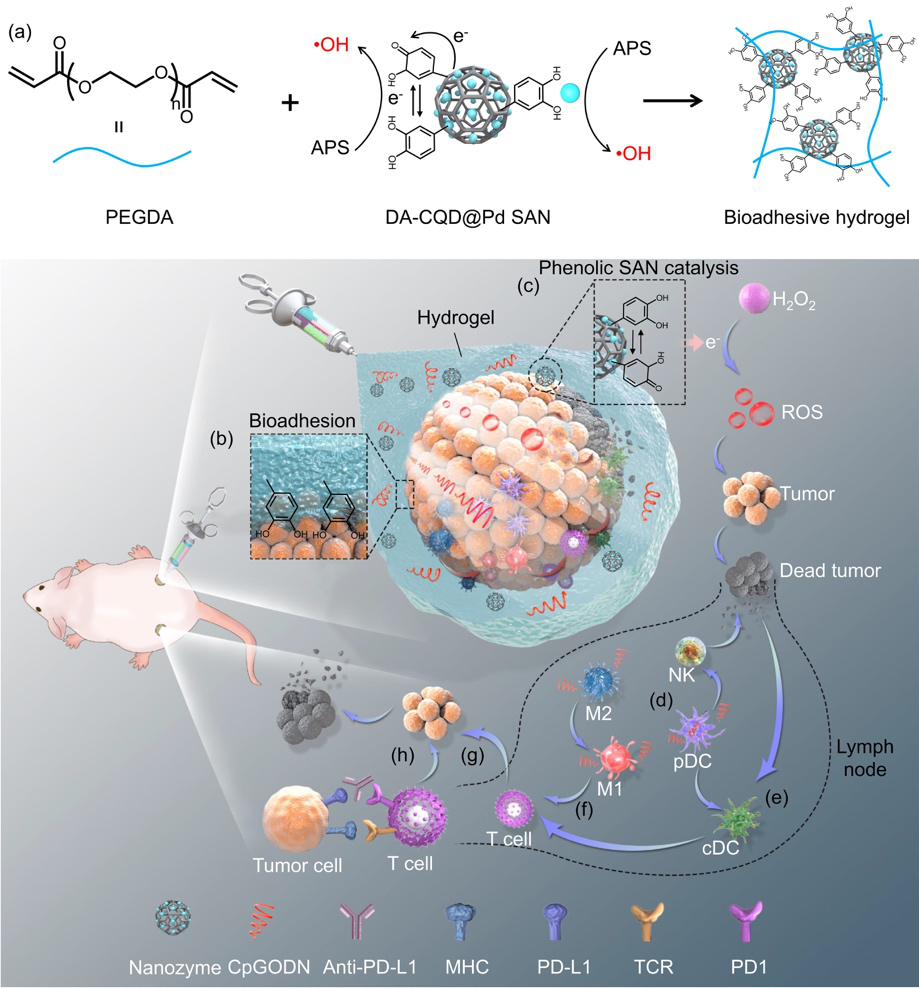
图 1. (a) SAN催化的PEGDA水凝胶聚合示意图;(b-h) DA-CQD@Pd@CpGODN生物粘附水凝胶介导肿瘤催化免疫治疗示意图
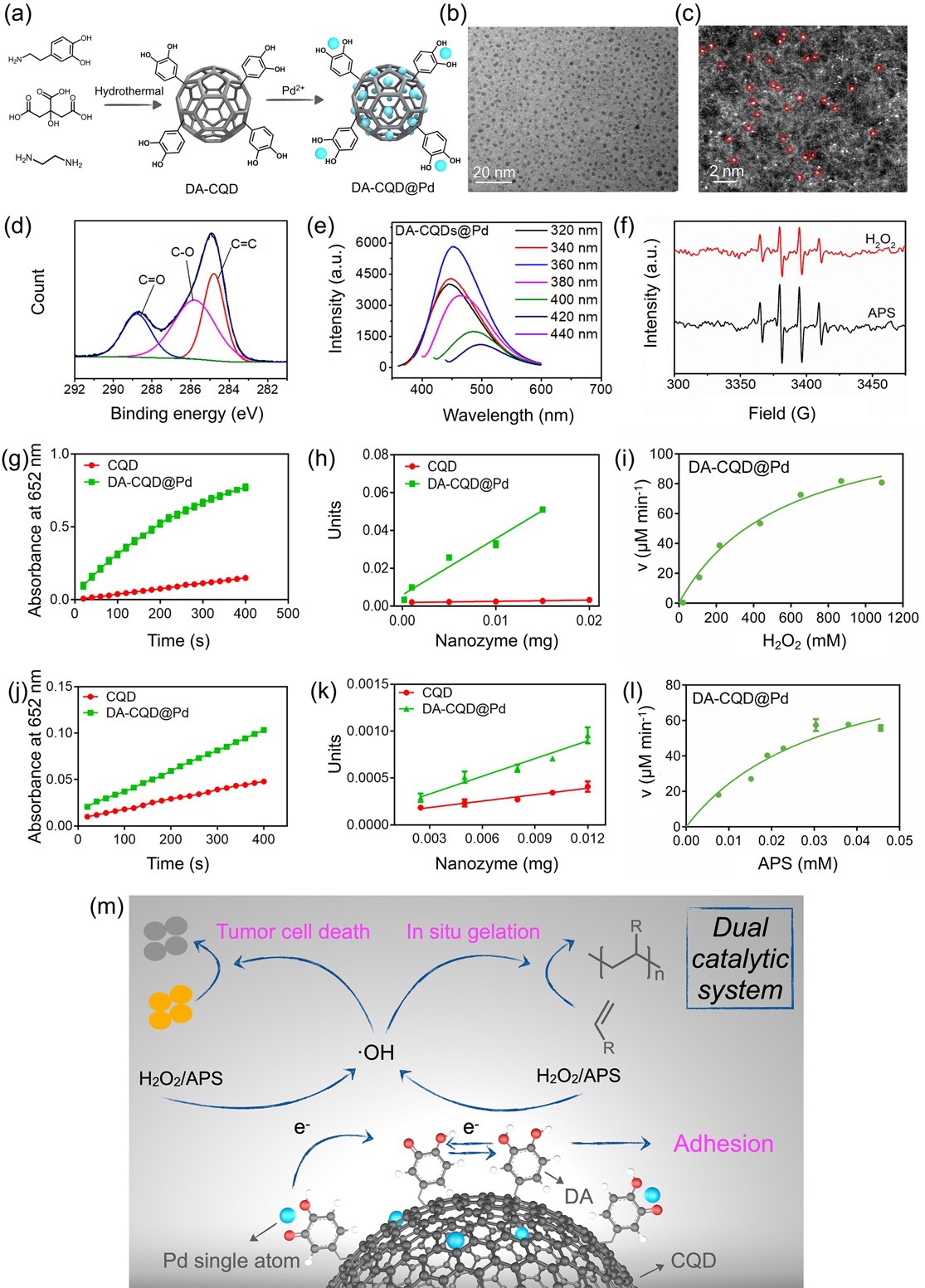
图 2. (a) DA-CQD@Pd SAN合成示意图; (b) DA-CQD@Pd SAN的TEM照片; (c)Pd单原子的球差电镜图片; (d) DA-CQD@Pd SAN的C1s XPS分析; (e) DA-CQD@Pd SAN的荧光光谱; (f) DA-CQD@Pd SAN在 APS 和 H2O2 存在下的ESR谱; (g, h) CQD和DA-CQD@Pd SAN在 H2O2存在下的的过氧化物酶(POD)活性和比活性; (i)不同 H2O2 浓度的DA-CQD@Pd SAN的 Michaelis-Menten曲线; (j, k) CQDs和DA-CQD@Pd SANs在APS存在下的类POD活性和比活性;(l)不同APS浓度的DA-CQD@Pd SAN的Michaelis-Menten曲线;(m) DA-CQD@Pd SAN的双重催化机制
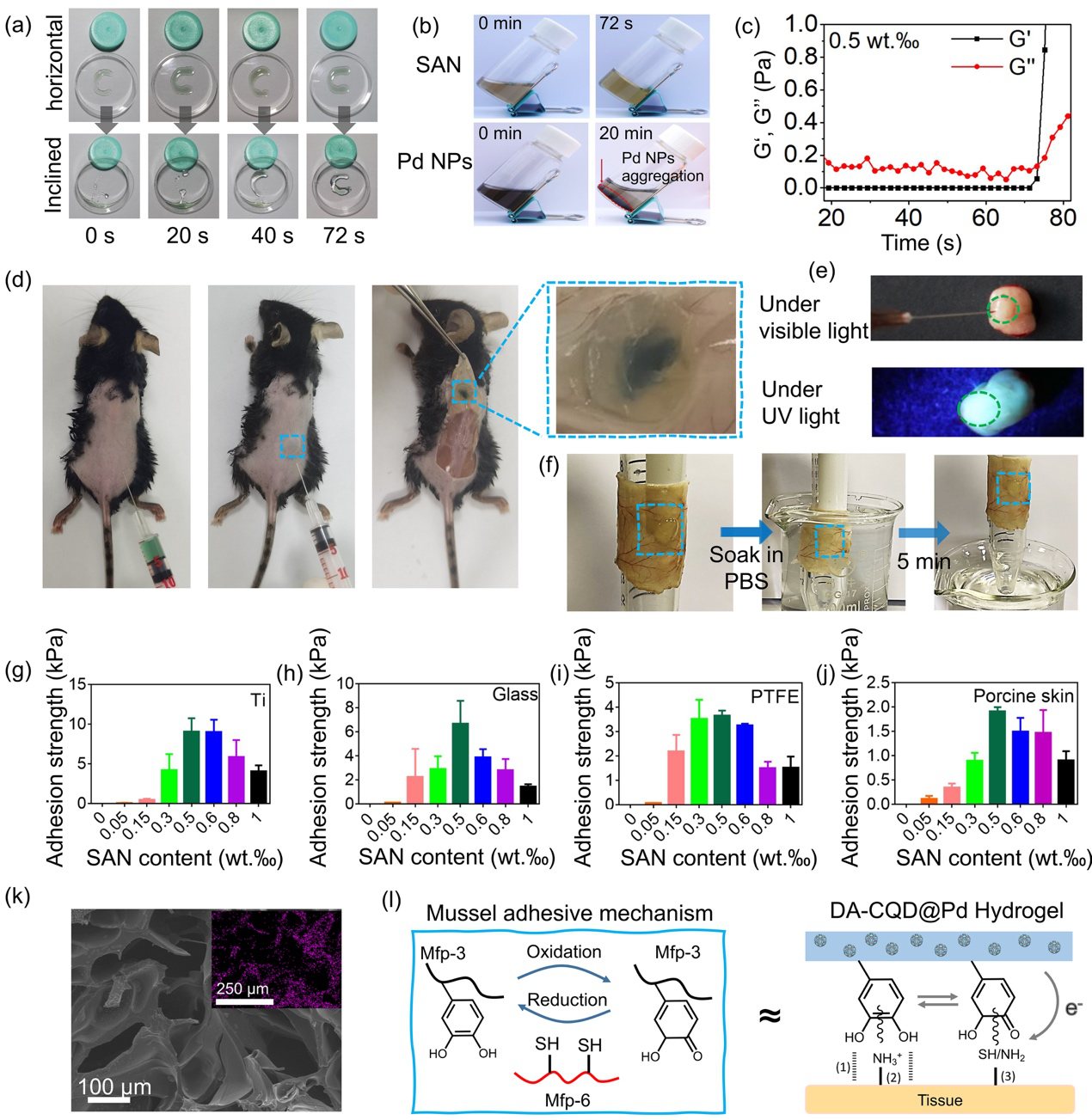
图 3. (a) DA-CQD@Pd水凝胶的原位自凝胶照片; (b) DA-CQD@Pd SAN催化引发水凝胶自固化,而Pd NPs不能; (c) DA-CQD@Pd水凝胶的流变特性; (d) DA-CQD@Pd SAN水凝胶的体内自凝胶照片; (e)水凝胶在肿瘤周围显示原位凝胶化,在紫外线照射下发出蓝光; (f)当浸泡在PBS中,DA-CQD@Pd水凝胶对大鼠皮肤牢固粘附; (g-j) 不同DA-CQD@Pd含量的 DA-CQD@Pd水凝胶对不同基材的粘附力; (k) DA-CQD@Pd水凝胶的SEM图像和Pd的元素面扫; (l) DA-CQD@Pd水凝胶在组织上的仿贻贝生物粘附机制

图 4. 4T1肿瘤细胞与(a)DA-CQD@Pd SAN和(b)DA-CQD@Pd SAN+H2O2 在不同浓度的DA-CQD@Pd SAN条件下的细胞活性; (c) DA-CQD@Pd水凝胶和 (d) DA-CQD@Pd 水凝胶+H2O2在不同DA-CQD@Pd SAN含量下的细胞活性; (e-h)不同处理后的4T1细胞的活/死染色; (i-l)不同处理后细胞内ROS的含量评价; (m-p) ROS的定量对比

图 5. 局部注DA-CQD@Pd@CpG ODN生物粘附水凝胶用于CT26肿瘤催化免疫治疗; (a) 实验过程的示意图; (b)不同治疗15天后肿瘤的图像; (c)肿瘤生长曲线; (d, e)不同治疗后小鼠的存活百分比和平均体重; (f, g)肿瘤浸润T细胞CD4+占CD45+ T细胞的比例和CD8+占CD45+ T细胞的比例; (h)免疫抑制性调节性T细胞(Tregs)占CD4+ T细胞的比例; (i)肿瘤中CD8+ T细胞/Tregs细胞的比率; (j)不同处理M2巨噬细胞的表达。
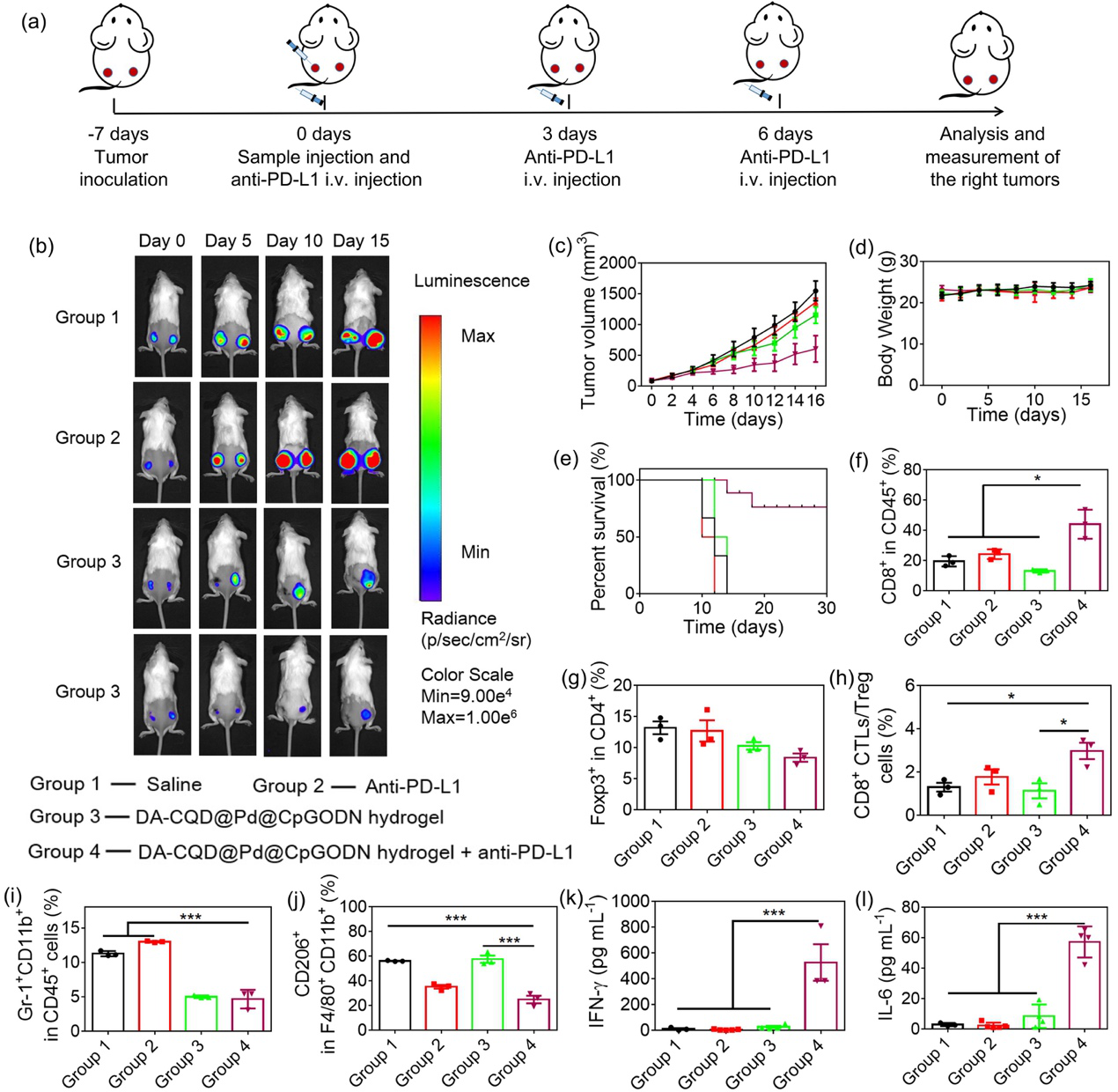
图 6. DA-CQD@Pd@CpG ODN水凝胶协同anti-PD-L1治疗远端肿瘤。(a) 实验过程示意图; (b)不同治疗后的CT26肿瘤生物发光成像; (c)不同治疗后远端肿瘤生长曲线; (d) 对照组和治疗组小鼠体重测定; (e)不同处理的生存曲线; (f)肿瘤浸润T细胞CD8+占CD45+ T细胞的比例; (g)免疫抑制调节性T细胞(Tregs)占CD4+ T细胞的比例; (h)肿瘤浸润CD8+ CTLs与Tregs的比值; (i)髓源性抑制MDSCs占CD45+ T细胞的百分比; (j)M2巨噬细胞(CD206+)占F4/80+CD11b+细胞的百分比; (k)不同处理后血清中IFN-γ和(l) IL-6的分泌水平。
论文以“Bioadhesive injectable hydrogel with phenolic carbon quantum dot supported Pd single atom nanozymes as a localized immunomodulation niche for cancer catalytic immunotherapy”为题发表于《Biomaterials》。论文第一作者为西南交通大学材料科学与工程学院博士生何欢和苏州大学纳米与软物质研究院硕士生费姿颖,论文通讯作者为西南交通大学鲁雄教授、谢超鸣副教授和苏州大学纳米与软物质研究院汪超教授。西南交通大学材料科学与工程学院为论文第一完成单位,该研究得到广东省重点领域研究发展计划、国家自然科学基金等重点项目的资助支持。
论文链接:https://doi.org/10.1016/j.biomaterials.2021.121272
- 北京化工大学蔡晴/喻盈捷 AFM:三重生物粘附性微球赋能金属离子工程化外泌体疗法,实现血管化骨再生 2026-02-18
- 南京林业大学黄超伯、熊燃华教授团队 AHM:实现伤口无缝合密封的快速止血和高韧性的生物粘附急救贴片 2024-11-15
- 江西科技师范大学卢宝阳/徐景坤 Small:3D打印高性能导电聚合物水凝胶生物粘附界面 2023-12-13
- 南京理工傅佳骏/姚博文团队 Nat. Commun.:类神经、导电通路可重构的水凝胶基一体化电子电路用于人-机整合 2026-02-14
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 南京大学王炜/曹毅/薛斌团队 Nat. Commun.:仿生分级picot纤维水凝胶涂层实现超低摩擦与高耐磨性 2026-02-09
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
