陕西师范大学杨鹏教授团队 JACS:α-螺旋介导的蛋白粘附
2023-08-03 来源:高分子科技
探索生物大分子在界面上的有序排列和聚合,有助于理解基于蛋白质的界面粘附机制,提高蛋白质基材料性能。在蛋白质粘附的界面模型中,β-折叠堆积和由此产生的淀粉样蛋白聚集被认为是驱动界面粘附的决定性因素。例如,藤壶通过以β-折叠为主的类淀粉样蛋白结构牢固地粘附在珊瑚礁或船舶表面。然而,粘附相关的β-折叠结构,是与界面结合前就预先形成的,还是无规卷曲/α-螺旋中的柔性蛋白链附着在界面上之后,才转化而成的,其机理尚未可知。
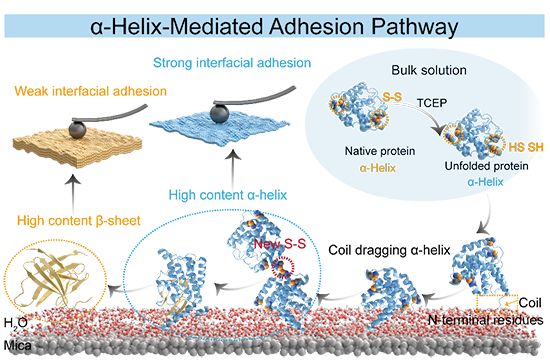
图1 通过α-螺旋介导的界面粘附模型
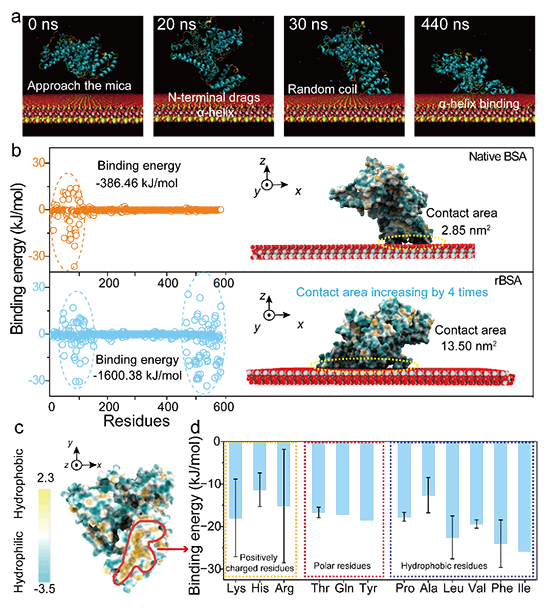
图2 rBSA 在云母表面自组装行为的分子动力学模拟
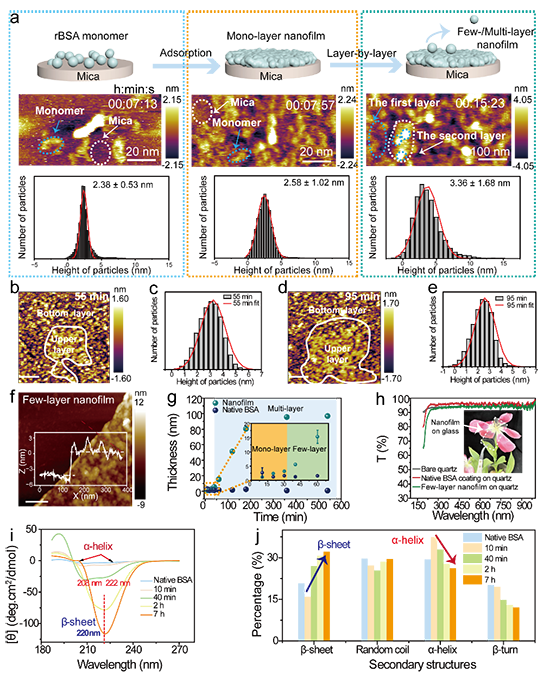
图3 rBSA在固液界面上的自组装
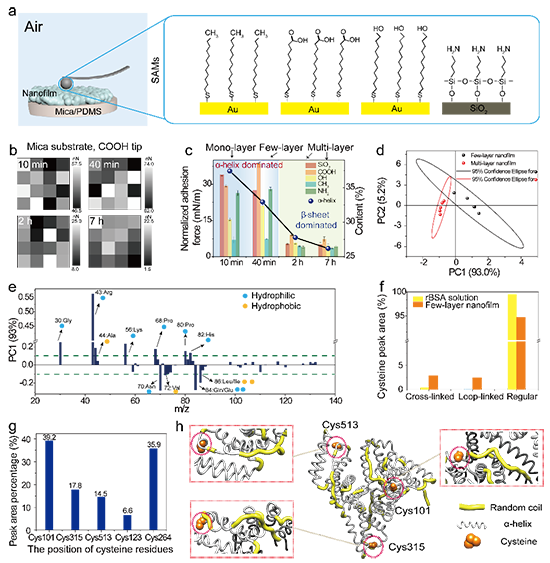
图4 具有不同二级结构的蛋白质纳米膜的粘附性能
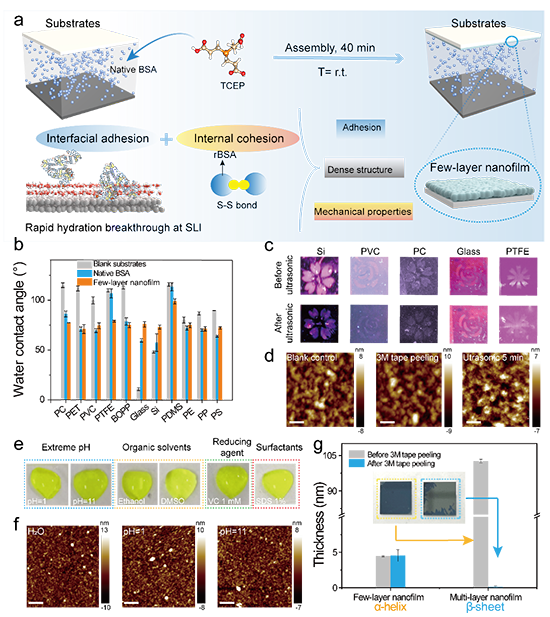
图5 纳米膜的粘附模型及稳定性测试
原文链接:https://doi.org/10.1021/jacs.3c03581
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 武汉大学陈朝吉/余乐 Natl. Sci. Rev.:可回收电凝胶化生物大分子水凝胶电解质助力可持续宽温域锌金属电池 2025-08-11
- 苏州大学李刚教授、美国国家标准与技术研究院Wai Cheong Tam博士 IJBM:牙周组织生物大分子研究进展 2025-05-22
- 苏大李刚、余嘉/港理大赵泽宇 Int. J. Biol. Macromol.:伤口修复生物大分子材料的研究进展 2024-04-03
- 大连理工大学郑楠/湖南大学邱烨 Biomacromolecules:具有α-螺旋结构的硫酸化糖基聚多肽的抗病毒活性研究 2023-06-15
- 华中科大罗亮、孟凡玲ACS Nano:多价纳米抗体大分子逐级倍增人胰岛淀粉样多肽聚集抑制剂效率的新策略 2021-08-06
- 上海科技大学钟超课题组《Sci. Adv.》:开发出功能可编程淀粉样蛋白涂层材料 2020-05-21
- 陕西师大杨鹏教授课题组:基于蛋白质类淀粉样聚集的抗污涂层 2020-05-06
