
第一作者:陈思亲,钟寅,范武发,相佳佳
通讯作者:申有青 教授
第一单位:浙江大学
DOI:10.1038/s41551-021-00701-4
在国家自然科学基金(51833008)和浙江省重点研发计划(2020C01123)的资助下,浙江大学申有青教授团队在主动转胞吞型高效抗肿瘤纳米药物的研究领域再次取得新的进展。继2019年提出了酶响应型纳米药物的肿瘤主动渗透新机制以来(Nature Nanotechnology),该团队成员持续致力于开发具有高效主动转胞吞作用的药物递送体系,并进一步提出了一种简化药物载体结构的策略:即利用能够弱黏附细胞膜、但不黏附蛋白质的两性离子聚合物为载体,使之同时具备血液长循环性能和不必发生酶催化反应就触发肿瘤细胞主动转胞吞的特性。这一策略不但极大地简化了纳米药物的结构,而且能够更加高效地外渗进入肿瘤组织并渗透扩散,将药物递送到瘤内所有细胞,获得极高的疗效,因此具备良好的临床转化潜力。相关研究成果以“Enhanced tumour penetration and prolonged circulation in blood of polyzwitterion–drug conjugates with cell-membrane affinity”为题,于2021年4月15日在线发表于国际著名学术期刊Nature Biomedical Engineering杂志上,申有青教授为通讯作者,浙江大学为第一单位。
近年来,纳米药物的临床应用取得了重大进展,其中一些纳米药物已经在临床上应用或处于临床试验阶段,但是几乎所有的纳米药物都未能达到预期的临床治疗效果。在肿瘤靶向的纳米药物递送过程中,纳米粒子必须经历血液长循环(Circulation)、肿瘤蓄积(Accumulation)、肿瘤浸润(Penetration)、肿瘤细胞内吞(Internalization)和药物释放(drug Release)这五步级联反应(CAPIR Cascade)才能有效地将药物递送到肿瘤细胞内[1-2]。EPR效应被公认为是纳米药物在肿瘤部位富集的主要因素,但是EPR效应在临床肿瘤中的发生率低且具有很强的异质性,导致基于EPR效应的纳米药物难以从血管进入肿瘤组织;同时,纳米药物固有的大尺寸(相对于小分子药物)和肿瘤微环境的致密性,使得纳米药物更加难以在实体肿瘤内渗透,导致无法将药物递送至远离血管的肿瘤细胞中发挥治疗作用。因此,肿瘤血管外渗困难和肿瘤组织渗透困难仍然是传统纳米药物难以克服的瓶颈。为了克服药物输送过程中的各种生理屏障,国内外研究人员设计了各种结构复杂的多功能纳米药物,但未能从根本上解决纳米药物依赖于EPR外渗和在瘤内被动扩散困境,其结构的复杂性也不可避免地增加了临床转化的困难。
本团队在前期工作中首次提出:基于主动转胞吞的纳米药物设计策略能够巧妙地利用肿瘤内细胞密度高的特点,让肿瘤血管内皮细胞/肿瘤细胞“主动地”在细胞间传递纳米药物,从而有效地外渗进入肿瘤组织并克服肿瘤微环境对纳米粒子被动扩散的障碍,打破了纳米药物递送过程中面临的外渗难和浸润难的瓶颈。但是,前期设计的主动转胞吞纳米药物需要先在肿瘤部位发生酶催化产生胺的反应才能触发肿瘤细胞的主动转胞吞作用[3-4],其载体结构相对比较复杂,有待进一步简化载体结构和提高递送效率。
本文亮点
在本项研究中,研究人员设计合成了一种含有三级胺氮氧结构的两性离子聚合物OPDEA,它具有不与蛋白质吸附却能与细胞膜可逆吸附的特性,因此能够“隐蔽”在血液循环系统中实现长循环和肿瘤富集;另一方面,它能快速被肿瘤血管内皮细胞和肿瘤细胞摄取,从而触发主动转胞吞作用并实现高效的肿瘤血管外渗和肿瘤主动渗透。基于此,研究人员利用OPDEA携载化疗药物7-乙基-10-羟基喜树碱(SN38)制备了以OPDEA为亲水外层、以SN38前药聚合物为疏水内核的肿瘤主动渗透型纳米载药胶束(OPDEA-PSN38)(图1a)。尾静脉注射后,该胶束能可逆地吸附到红细胞上而不吸附血浆蛋白,具有较好的血液长循环;一旦到达肿瘤部位,它能弱吸附在肿瘤血管内皮细胞上并触发其转胞吞作用,快速外渗至肿瘤组织中,进而通过肿瘤细胞的转胞吞作用实现高效的肿瘤渗透,能够浸润到乏血管、缺氧甚至坏死区域,从而将药物递送到所有细胞,最终彻底消灭肿瘤组织中所有的肿瘤细胞(图1b)。与临床一线化疗药物伊立替康(CPT-11)及其脂质体相比,该纳米药物在多种荷瘤小鼠模型(包括肝癌原位模型和人源肿瘤异种移植瘤模型)中均表现出优异的抑瘤作用,在常规给药剂量下,它不仅能清除起始肿瘤大小为70 mm3的小肿瘤,也能清除起始肿瘤大小为500 mm3的大肿瘤,而且生物安全性良好,不会产生停药反弹等副作用(图1, c-f)。

图1 OPDEA-PSN38胶束的肿瘤主动渗透机理示意图和抑瘤曲线。(a)OPDEA-PSN38胶束的化学结构。(b)OPDEA-PSN38在肿瘤部位的转胞吞作用和肿瘤渗透机理:i)胶束能可逆吸附在红细胞上进行血液长循环,ii)通过EPR效应在被动扩散至肿瘤组织,iii)通过肿瘤血管内皮细胞的主动跨细胞转运/转胞吞作用在肿瘤组织蓄积,iv) 在肿瘤组织中基于转胞吞作用实现主动渗透。(c-d)OPDEA-PSN38胶束在肝癌皮下小肿瘤模型(c,初始肿瘤体积~70 mm3)和大肿瘤模型(d,初始肿瘤体积~500 mm3)中均表现出根治性的治疗效果;(e)在肝癌原位肿瘤模型中,OPDEA-PSN38胶束治疗组的小鼠肿瘤被彻底清除;(f)在肝癌PDX模型中,OPDEA-PSN38胶束的抑瘤作用显著优于同等治疗剂量和更高治疗剂量的临床一线药物(CPT-11)治疗组。

图2 OPDEA能够弱黏附细胞膜,因此不需要发生结构转变就能同时具备血液长循环性能和被肿瘤细胞內吞的能力。(a)等离子共振实验证明OPDEA与细胞膜磷脂具有较强的分子间相互作用力;(b)分子模拟实验证明OPDEA与磷脂能形成较强的氢键相互作用;(c)红细胞吸附-洗脱实验证明OPDEA能在红细胞上可逆吸附,有利于实现血液长循环和肿瘤富集;(d)血浆清除实验证明OPDEA的血液循环时间长;(e)小动物活体成像实验证明OPDEA具有良好的肿瘤靶向富集作用;(f)肿瘤细胞內吞实验证明OPDEA能快速被细胞摄取,有利于触发肿瘤细胞的转胞吞作用。

图3 OPDEA能触发肿瘤血管内皮细胞和肿瘤细胞的主动转胞吞作用,从而快速外渗进入肿瘤组织并彻底渗透。(a-b)Transwell实验证明OPDEA(a)或OPDEA-PSN38胶束(b)能触发血管内皮细胞的转胞吞作用。其中,癌化的内皮细胞(ECDHCC-1)具有比正常内皮细胞(HUVEC)更高效的转胞吞作用;血液流速会降低转胞吞速率。(c-d)透射电镜图像证明OPDEA-PSN38胶束能触发ECDHCC-1细胞(a)和实体肿瘤血管内皮细胞(b)的转胞吞作用,因此内皮细胞中具有大量转胞吞囊泡(红色星号)、细胞突触(蓝色箭头)和内皮细胞膜的窗孔结构(红色箭头);(e)激光共聚焦显微镜实时成像证明尾静脉注射的OPDEA能够快速发生血管外渗并充分浸润到肿瘤组织内部。
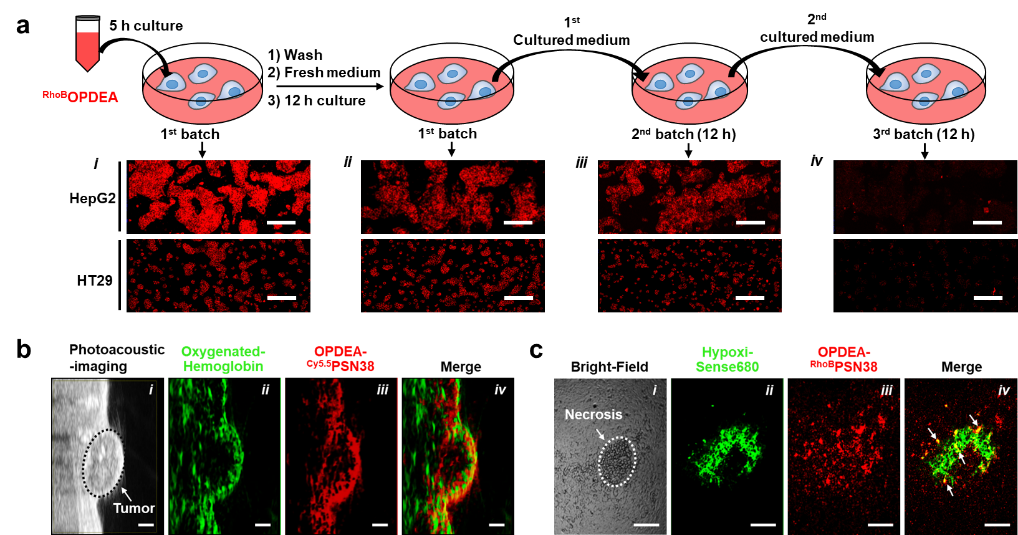
图4 OPDEA-PSN38胶束能通过主动转胞吞作用快速浸润到肿瘤组织中的乏血管、缺氧甚至坏死区域。(a)跨细胞传递实验证明OPDEA在肿瘤细胞中能通过不断的“內吞-外排”作用实现快速的转胞吞作用;(b)光声成像实验证明OPDEA-PSN38胶束能渗透到实体肿瘤的乏血管区域;(c)免疫荧光染色实验证明OPDEA-PSN38胶束能渗透到实体肿瘤的缺氧区域和坏死区域。
综上所述, N-O结构具有的弱黏附细胞膜、但不黏附蛋白质的特性,赋予了纳米药物CAPI所需的所有功能,即血液长循环、不依赖于传统被动蓄积机制(EPR效应)的肿瘤血管主动外渗、高效瘤内渗透和快速细胞内吞,纳米药物疗效高且结构简单。与将多种功能组分组装获得多功能纳米药物(All functional components-into-One)的方法相比,这种单一结构赋予多种所需功能(One-for-all functions)来简化纳米药物结构的方法,为临床转化纳米药物的设计提供了新的思路。目前此项专利技术已转让海南普利制药股份有限公司进行临床转化。
参考文献
[1] Sun Q., Zhou Z., Qiu N., et al. Rational design of cancer nanomedicine: Nanoproperty integration and synchronization. Adv Mater, 2017, 29: 1606628.
[2] Zhou Z., Liu X., Zhu D., et al. Nonviral cancer gene therapy: Delivery cascade and vector nanoproperty integration. Adv Drug Deliv Rev, 2017, 115: 115-154.
[3] Zhou Q., Shao S., Wang J., et al. Enzyme-activatable polymer-drug conjugate augments tumour penetration and treatment efficacy. Nat Nanotechnol, 2019, 14: 799-809.
[4] Wang G., Wu B., Li Q., et al. Active transportation of liposome enhances tumor accumulation, penetration, and therapeutic efficacy. Small, 2020, 16: e2004172.
论文链接:
https://dx.doi.org/10.1038/s41551-021-00701-4
https://www.nature.com/articles/s41565-019-0485-z
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 天津大学刘文广教授/杨建海教授团队 Small:“溶剂极性诱导”策略制备兼具强韧、高阻尼、抗冻性的超分子两性离子聚合物有机凝胶 2025-05-27
- 北工商高海南课题组 Sci. China Mater.:盐度超敏感离子水凝胶用于盐度检测和智能液体阀门 2023-11-30
- 浙工大杨晋涛/郑司雨《Chem. Eng. J.》:具有多信号检测功能的智能聚两性离子门控膜 2023-08-05
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
