纳米药物凭借其较好的靶向性在肿瘤的靶向治疗中展现出巨大的希望,但是纳米药物在肿瘤部位的滞留时间短的问题仍有待解决。如何对纳米载体进行功能化,使其能灵活调控纳米粒的尺寸,既能凭借较小的粒径靶向肿瘤部位,又能在肿瘤部位原位增大粒径而延长滞留时间是目前亟需解决的一大难题。
针对这一问题,嘉兴学院附属第二医院陈刚主任、上海交大医学院附属瑞金医院崔文国教授和赫尔辛基大学Helder Santos教授联合开发了一种光控粒径可变的纳米体系用于提高药物在骨肉瘤部位的靶向滞留性。通过合成紫外敏感的DOX-NB-PEG作为聚合物载体和化疗剂,上转换颗粒UCNP作为光引发剂,ICG作为光治疗剂和成像剂,利用UCNP表面修饰的PLGA与ICG和DOX端的交联,自组装形成可通过近红外光在肿瘤部位原位调控粒径大小的纳米体系。它受到近红外光激活后能自动脱去表面的PEG,同时内部结构发生聚集,形成粒径更大的纳米颗粒,延长纳米药物在肿瘤部位的滞留时间,实现骨肉瘤的靶向协同治疗(图1)。

图1 (A) 光控纳米体系的构建以及光控粒径变化过程;(B)光控纳米体系用于肿瘤的协同治疗过程
研究表明,经980纳米近红外光激活后,纳米体系的内部结构发生了响应性聚集,形成粒径更大的体系。同时,该纳米体系进一步接收到785纳米的激光照射后,也能产生良好的光热和光动力治疗的效果(图2)。
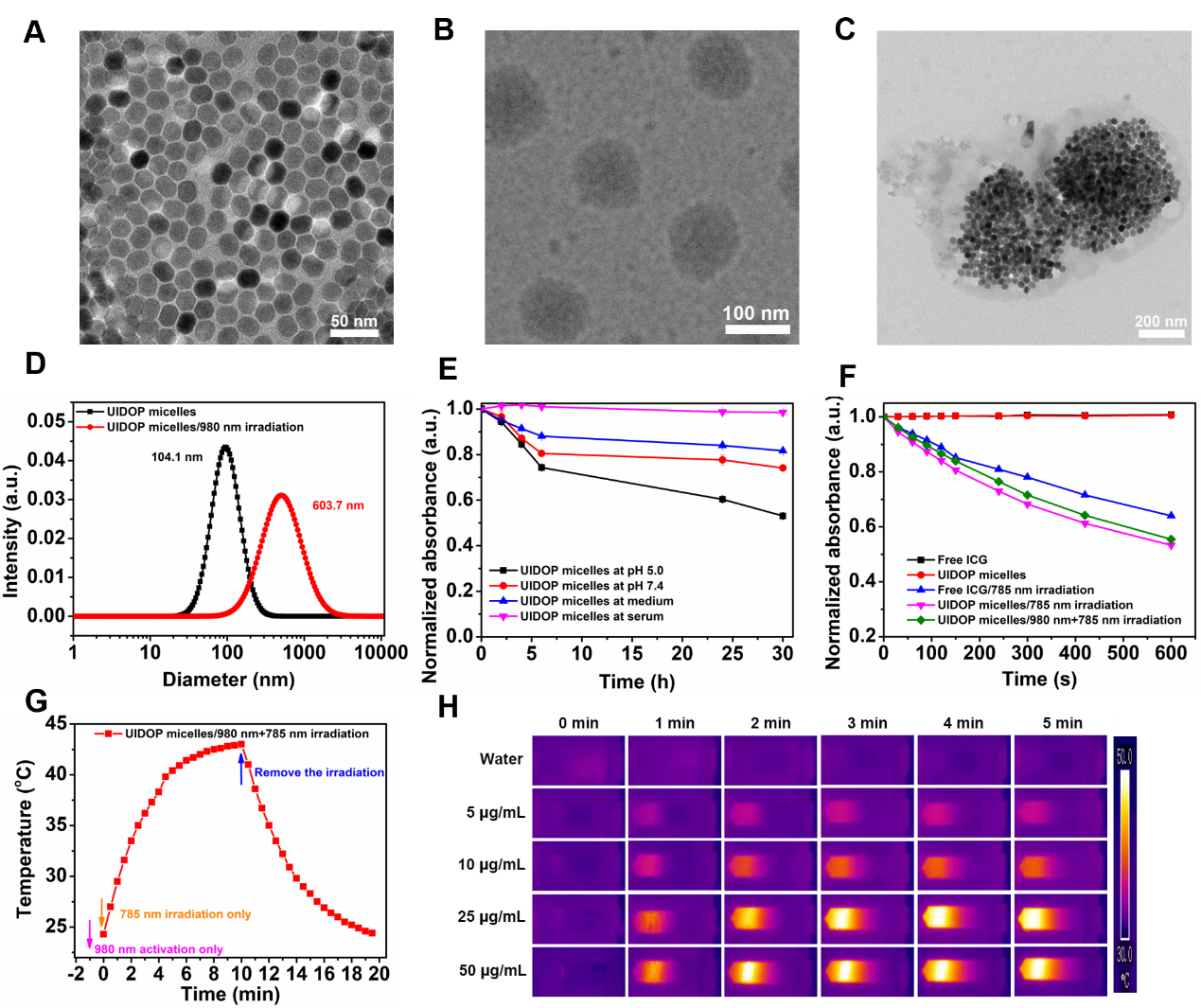
图2. (A) 上转换颗粒UCNP;(B) UIDOP micelles;(C) 经980 nm光激活后的UIDOP micelles (D)动态光散射法测粒径;(E) 化学稳定性;(F) DPBF探针测活性氧;(G) 光热转换效率实验;(H) 光热效应
研究人员进一步细胞研究发现,UIDOP micelles经980 nm近红外光激活后,其表面PEG的脱落在一定程度上提高了药物的细胞摄取量。此外,在受到进一步785 nm光照射后,该体系也能抑制HUVEC细胞成管(图3)。
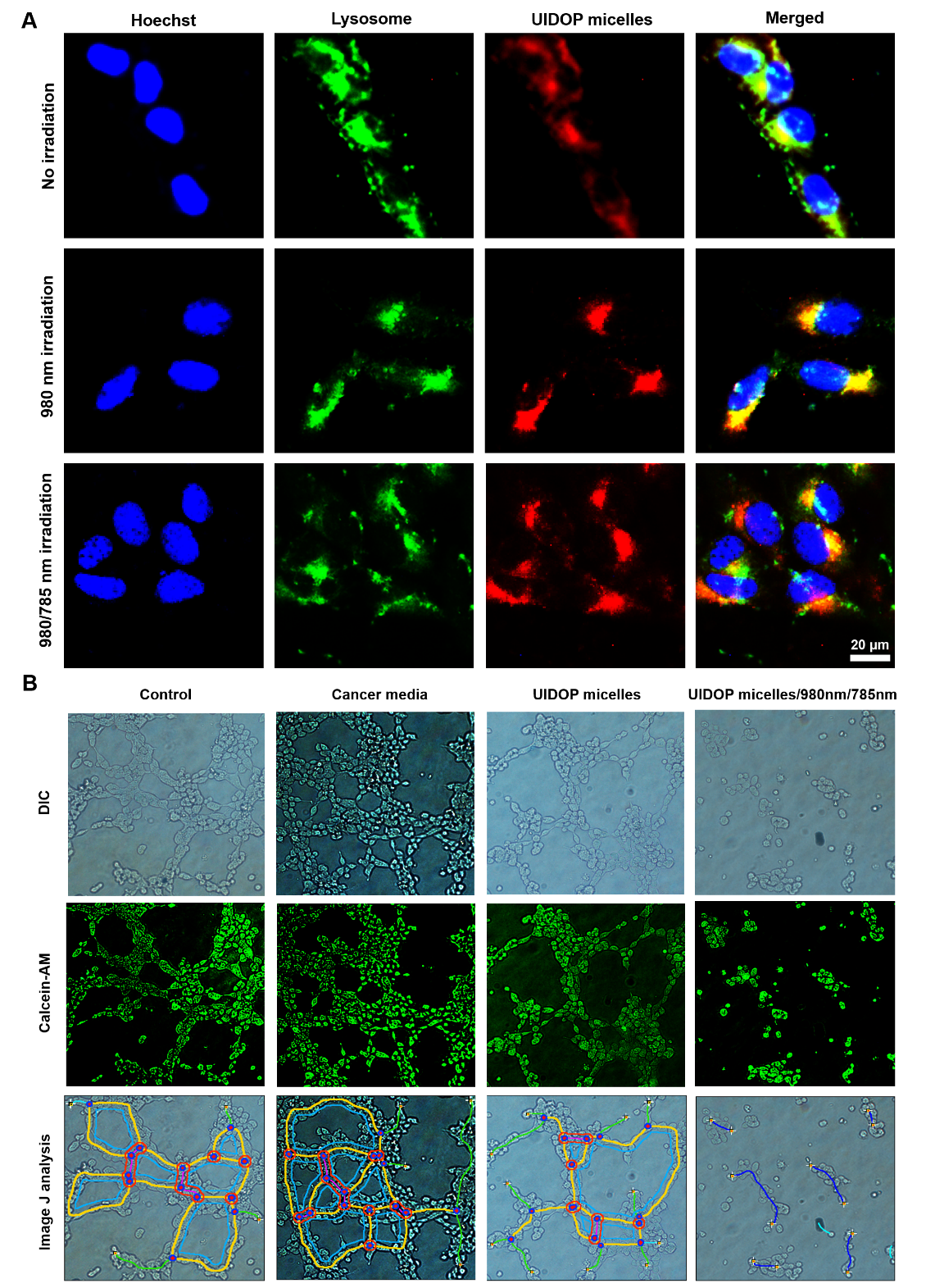
图3 (A) UIDOP micelles的细胞内行为; (B) UIDOP micelles受到光照后抑制HUVEC成管
在小动物成像实验中,经980 nm光激活后形成的粒径更大的纳米体系在同一时间点时表现出更高的荧光信号值,延长了药物在肿瘤部位的滞留。热成像实验也再次证明该体系在体内所具有的光热效应(图4)。

图4 光控纳米体系的相关体内实验.(A,B)活体成像实验;(C,D,E)离体组织分布研究;(F,G)热成像研究
在皮下瘤的小鼠骨肉瘤动物模型中,UIDOP micelles/980/785 irradiation表现出优异的抑制肿瘤效果。相对比于其他组,UIDOP micelles/980/785 irradiation表现出明显的组织损伤,同时通过免疫组化也发现,肿瘤增殖指标Ki67的表达也大大下降。这个自组装的纳米体系在骨肉瘤靶向协同治疗中展现出有效的治疗效果,为肿瘤的靶向协同治疗提供了一个有效的策略。
以上相关成果发表在Advanced Functional Materials, 2021, 2101262上。该文章第一作者为罗欢欢、孔丽、张峰,通讯作者为陈刚主任、Helder Santos教授、崔文国教授。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202101262
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 香港中文大学(深圳)唐本忠团队 Nat. Commun.:均聚多肽自组装体系圆偏振室温磷光 2026-02-24
- 清华大学化学系许华平教授课题组招聘博士后 2026-01-14
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
