生物成像是了解生物体组织结构,阐明生物体各种生理功能的一种重要研究手段。无损伤的体内成像技术在临床医学诊断中的应用越来越受到重视。荧光成像有着高时空分辨率特点,具有其它成像方式无法比拟的优势。相对于可见光(400–700 nm)和近红外一区(NIR-I,700–900 nm)成像,最近迅速发展的近红外二区(NIR-II,1000–1700 nm)成像使成像深度和分辨率有了更大的改善,越类越获得人们的亲睐。
然而,迄今为止,能够产生NIR-II荧光的材料主要有以下三大类:1)无机纳米粒子;2)有机荧光染料小分子;3)有机共轭聚合物。无机纳米材料如硫化银、碳纳米管、上转换纳米粒子等虽有着良好的NIR-II 荧光性能,但它们在体内排泄速度缓慢,对肝、脾有长期的毒性;有机NIR-II小分子如CH1055,毒性小,生物相容性好,但NIR-II小分子分子量大、水溶性差,一般需要被包裹或者化学键合到载体材料、纳米粒子上才可被使用,导致它们的利用效率低,批次差异大,不稳定,容易突释等一系列问题;有机共轭聚合物,一般因其碳-碳键形成独特的π共轭结构而具有荧光、光热、光动力等性能,但也正是因这种共轭结构,导致了聚合物难以降解、生物相容性差等问题,它们在生物活体内的使用一直饱受争议。因此,发展生物相容性好、可生物降解、具备近红外二区发光能力的高分子药物载体材料,具有重要的意义和科学价值。
纳米药物进入人体后,往往犹如进入黑匣子。实时监测药物并及时反馈药物的治疗效果,可了解药物在机体内的运动规律,包括研究药物的吸收、分布、代谢、转运及排泄、机体生理反应及药物疗效和毒副作用等一系列过程,为追踪患者的癌症病情进展,预后判定和方便医生制定后续给药方案提供重要依据,是实现肿瘤精准治疗的关键。近红外二区荧光高分子材料能够以无创的方式跟踪药物分子被递送到何处,何时得以释放等过程,但当前具有近红外二区发光能力的纳米药物无法在实现药物的活体追踪的过程中,还能够及时反馈药物的治疗效果,这类纳米载药体系,临床意义重大,但面临着巨大挑战。
中国科学院化学研究所肖海华研究员团队通过多步反应首次合成了一双羟基官能化的NIR-II荧光分子,并以该分子作为聚合单体,同ROS敏感的双羟基单体、四酸酐进行共聚反应,从而获得了肿瘤微环境敏感的生物可降解近红外二区聚合物。随后,该团队利用此聚合物来包裹高毒高效、作用机制不同于临床上现有传统铂类药物的新型铂类药物56MESS(一种DNA嵌入剂),最终形成了可进行肿瘤深层次成像和可对肿瘤凋亡进行成像的纳米载药体系。一方面,直径约40 nm的复合纳米粒子(NP3)能通过靶向分子RGD靶向肿瘤细胞。进入癌细胞后,它在高表达ROS的肿瘤细胞内崩解,释放出高毒性化疗药物56MESS,促进癌细胞凋亡;另一方面, NP3可发出近红外二区荧光,进而对NP3在细胞或活体内的位置进行精确定位。更为重要的是,键合在NP3内部的5’-FAM-DVED-dabcyl在细胞死亡后释放出的Caspase-3作用下发光,进而实时反馈细胞凋亡情况。共聚焦显微镜和流式细胞术证实了NP3的NIR II荧光的定位和反馈细胞凋亡的能力。最后,该团队在肺癌多药耐药的人源化动物模型(患者经过多次化疗失效导致肿瘤耐药和复发的PDXMDR模型)上对NP3进行了活体成像分析,发现NP3可高效的靶向到肿瘤部位。肿瘤生长抑制实验进一步证实了NP3显著的抑制了PDXMDR的增长,且具较低的全身毒性。此外,NP3的凋亡检测功能也在肿瘤切片中得以验证。综上所述,该研究从设计、合成、运用新高分子载体材料的角度为肿瘤诊疗一体化带来了新思路。

Scheme 1. 具有红外二区荧光成像和肿瘤凋亡检测功能的NP3可显著抑制多药耐药的肺癌人源化动物模型(PDXMDR)的增长。
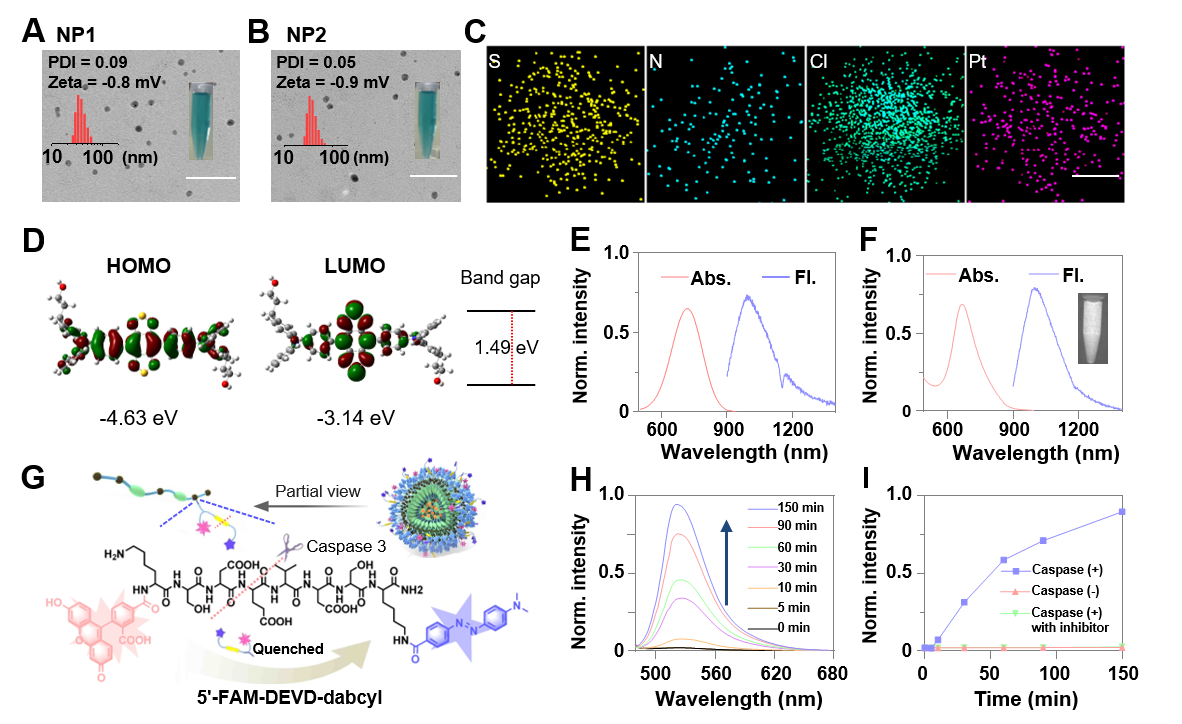
图1.可对caspase-3酶响应的可生物降解的近红外二区荧光聚合物纳米粒子的体外表征。(A)和(B)TEM和DLS 对NP1和NP2的表征。(C)STEM 对NP2的表征。(D)10的HOMO和LUMO轨道分布。(E)10 和(F)NP3的吸收光谱和荧光发射光谱。(G)H2O2引起的聚合物降解、NP3分解以及随后caspase-3对凋亡探针5''-FAM-DEVD-dabcyl的活化。(H)、(I)NP3中的5''-FAM-DEVD-dabcyl 对caspase-3响应所带来的荧光性能变化。
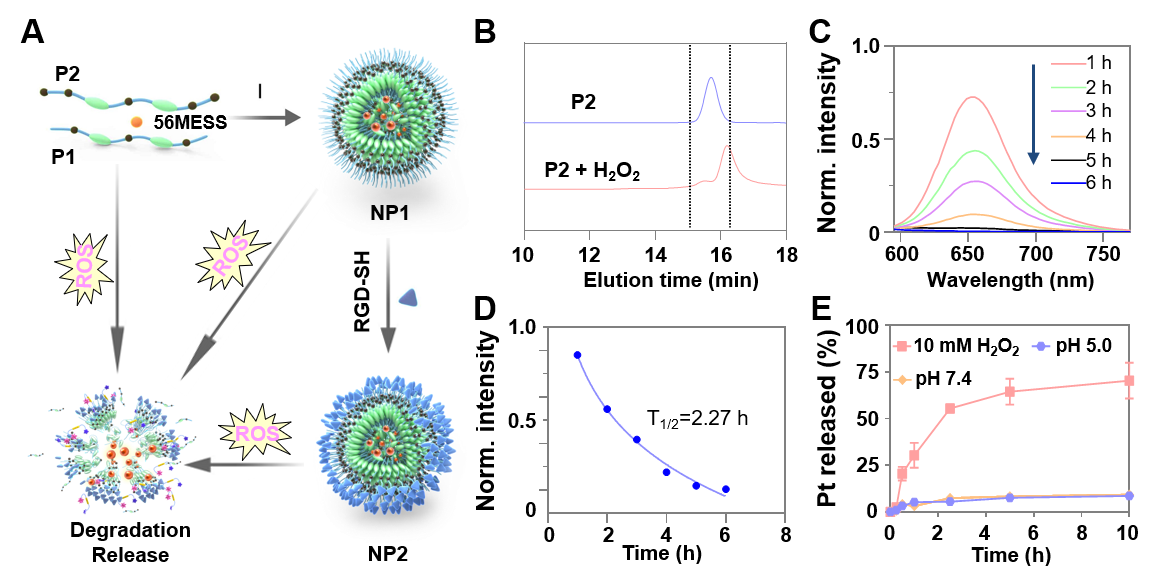
图2. 近红外二区荧光高分子的生物降解和纳米粒子的可能离解过程。(A)P1和P2降解的示意图。(B)H2O2触发的聚合物降解前后的GPC曲线。聚合物包载尼罗红的荧光光谱(C)和特征荧光峰值(D)变化。(E)NP2的药物释放曲线。

图3. 负载56MESS的近红外二区荧光高分子纳米粒子的细胞成像和抗癌活性研究。(A)顺铂,56MESS,NP1和NP2对多种顺铂敏感和耐药的癌细胞系的杀灭能力研究。(B)近红外二区荧光和细胞凋亡成像的简要原理示意图。(C)NP4和NP3的激光共聚焦细胞成像图像。红色来自红外二区荧光的聚合物。绿色来自凋亡成像探针5''-FAM。(D)NP3和NP4的流式凋亡定量。(E)NP1和NP2的细胞铂内吞。

图4. 通过红外二区荧光成像和细胞凋亡成像检测纳米粒子在3D肿瘤细胞球体中的蓄积。(A)3D细胞球对纳米粒子的摄取和凋亡成像研究。(B)近红外二区荧光和细胞凋亡成像的简要原理示意图。(C-E)纳米粒子的内吞摄取和细胞凋亡成像荧光成像的半定量分析。
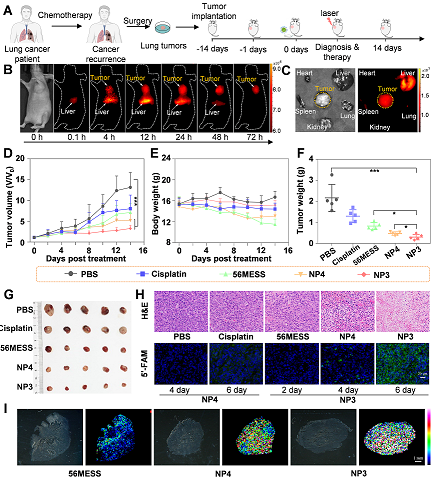
图5. 近红外二区生物可降解高分子铂药纳米粒子在肺癌PDXMDR模型中进行的靶向治疗及生物成像和凋亡检测。(A)多药耐药的肺癌PDXMDR模型的构建过程以及活体成像、治疗的简要示意图。(B)活体和离体代谢和分布实验。(D-E)肿瘤抑制曲线、体重曲线、肿瘤称重、肿瘤大小图片等。(H)病理切片和凋亡检测。(I)MALDI-TOF/MS成像技术对药物的分布进行原位的检测。
以上研究成果近期发表在ACS Nano期刊上。本论文通讯作者为中国科学院化学研究所肖海华研究员。上述研究工作得到了国家自然科学基金、科技部重大专项等项目的支持。
原文链接:
A Near-Infrared-II Polymer with Tandem Fluorophores Demonstrates Superior Biodegradability for Simultaneous Drug Tracking and Treatment Efficacy Feedback
Dengshuai Wei,& Yingjie Yu,& Yun Huang, Yuming Jiang, Yao Zhao, Zongxiu Nie, Fuyi Wang, Wen Ma, Zhiqiang Yu, Yuanyu Huang, Xiao-Dong Zhang, Zhao-Qian Liu, Xingcai Zhang, and Haihua Xiao*
ACS Nano, 2021, DOI: 10.1021/acsnano.1c00076
https://doi.org/10.1021/acsnano.1c00076
肖海华研究员简介
中国科学院化学研究所肖海华研究员博士于2012年毕业于中科院长春应化所,师从景遐斌研究员、陈学思院士。近10年来,肖海华研究员立足生物医用高分子,聚焦金属铂类药,系统性地从事铂类药物的高分子新剂型及它与药物、基因等进行联合的载药体系的开发和临床转化研究。课题组围绕三大策略,即跨越铂类药物进入细胞的生物屏障、解除细胞对铂药的解毒机制、抑制细胞对铂形成的DNA加合物进行修复,来构建高分子铂类药物的纳米递送体系,以期降低铂类药物的毒副作用、增加疗效、抑制临床耐药的发生。目前,肖海华研究员已共发表>80篇学术论文,以第一/通讯作者在Nat. Biomed. Eng.、Prog. Polym. Sci.、Adv. Mater.、Adv. Funct. Mater.、J. Am. Chem. Soc.、Nano Lett.、ACS Nano、Mater. Today、 Coordin. Chem. Rev.、Biotechnol. Adv.、Biomaterials等期刊上发表>40篇论文,影响因子>10的20余篇;申请中国专利12项,获授权中国专利7项,美国专利2项;已荣获湖北省科技进步一等奖(2019年,排名:3/14)、吉林省自然科学二等奖(2015年,排名:3/5)、中美纳米医学与纳米生物技术学会未来科学家奖(2017年);应邀担任中华预防医学会生物资源管理与利用分会青年委员会副主任委员,中国生物医学工程协会纳米医学与工程协会青年委员,中国医药生物技术协会造影技术分会青年委员。
- 四川大学何斌/蒲雨吉 ACS Nano:高分子化丁酸纳米平台治疗肠炎 2023-12-24
- 华南理工朱伟 Adv. Sci.:基于红细胞和MOF-级联酶的人工生物杂化体用于高尿酸血症治疗 2023-12-17
- 长期有效 | 西南交大周绍兵教授团队诚招博士、推免硕士 - 材料、生物医学工程 2023-09-23
- 浙大姚克教授团队《Adv. Drug Deliver. Rev.》综述:纳米药物载体在眼病治疗中的研究现状与展望 2023-03-17
- 四川大学郭少云/李春海团队 Macromolecules:吹膜加工外场下生物降解材料PBAT结构与性能的演变机制 2026-02-11
- 四川大学何斌/成都大学高文霞 Adv. Mater.:具有无规-嵌段分子链结构的生物降解共聚物用于高性能可吸收组织结扎夹 2025-12-29
- 沈化大康海澜教授、华南理工王朝教授 Macromolecules:动态硫化法制备高耐油性的生物基可生物降解热塑性弹性体 2025-07-30
