由两亲性嵌段共聚物通过自组装形成的聚合物囊泡,具有稳定性高、包载能力强的优点,作为药物载体材料受到广泛的关注。刺激响应型聚合物囊泡能对外界刺激产生响应,可应用于靶向药物传递、可控释放等领域。活性氧类(ROS)作为生物体内有氧代谢的副产物,因其强氧化性和在肿瘤和炎症组织的特异性富集而作为一种刺激源,可刺激氧化响应性囊泡作出反应。而要真正将这类聚合物囊泡应用于生物医用领域,其生物相容性十分关键。
聚类肽(polypeptoid)是一类酰胺键上的质子被取代的聚氨基酸分子,具有良好的生物相容性。因为分子间和分子内不存在氢键相互作用,聚类肽能够溶解于大部分有机溶剂,和常规的聚肽(polypeptide)分子相比更易制备和应用。法国巴黎高科化学学院李敏慧教授和浙江大学凌君教授合作,设计制备了一种完全由聚类肽构成的氧化响应性聚合物囊泡。这种共聚物的疏水段是一种侧链含硫醚键的新型聚类肽:聚(N-3-甲硫基丙基甘氨酸) (PMeSPG),亲水段则由具有优良水溶性和抗蛋白粘附能力的聚肌氨酸(PSar)构成。共聚物通过两种N-硫代羧基内酸酐(MeSPG-NTA和Sar-NTA)的顺序分段投料聚合合成(图1)。通过纳米沉淀法、双乳液法等自组装方法,PMeSPG-b-PSar能分别形成纳米和微米尺度的聚类肽囊泡。
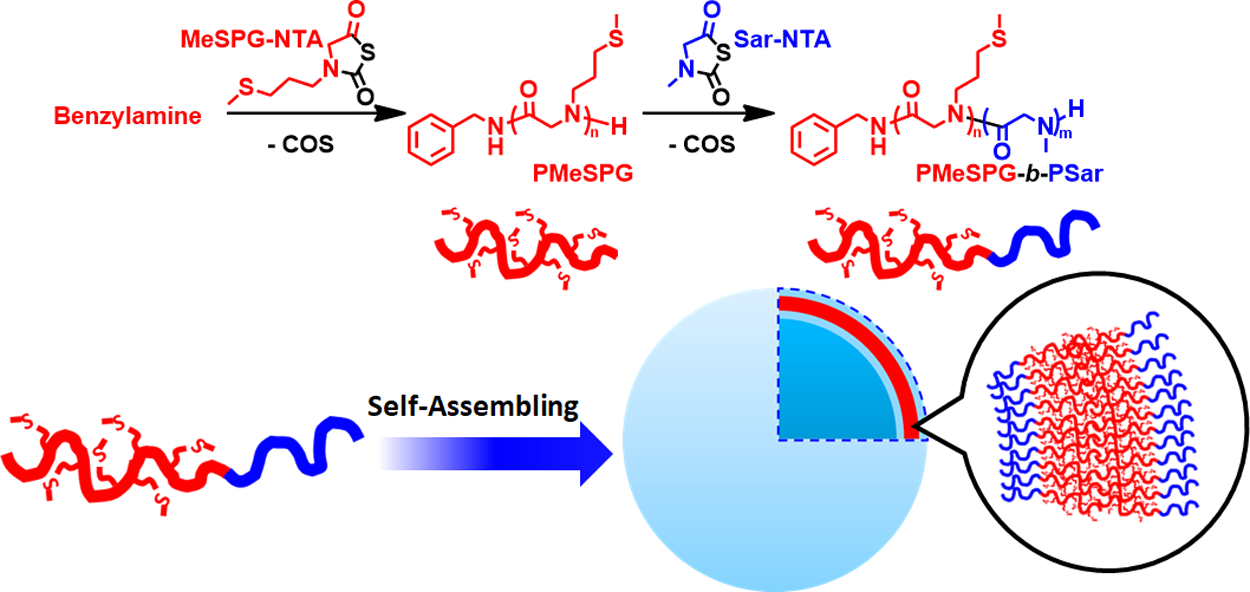
图1. 共聚类肽PMeSPG-b-PSar的合成与自组装
PMeSPG-b-PSar的氧化响应性来自于侧链硫醚键在氧化条件下转化为高度亲水的亚砜基的反应,这会导致PMeSPG段的亲疏水性发生彻底转变,从而使得囊泡失稳崩解。经纳米沉淀法形成的纳米囊泡在双氧水(H2O2)溶液处理下完全消失,只剩下极少数松散絮状结构。而在共聚焦显微镜的表征下,由双乳液法获得的微米囊泡(尼罗红标记)在8.8 mM H2O2刺激下随时间逐渐崩解的过程被完整记录下来。如图2A所示,在加入H2O2刺激后,囊泡随着膜结构的绷紧而首先形成更规整的球形结构,接着囊泡膜开始抖动,且抖动随时间愈发剧烈,囊泡膜表面形成许多孔隙,最终在225 s左右囊泡完全崩解。动态的核磁跟踪(1H NMR,图2B)转变揭示了囊泡内共聚物在氧化条件下的结构和行为变化。
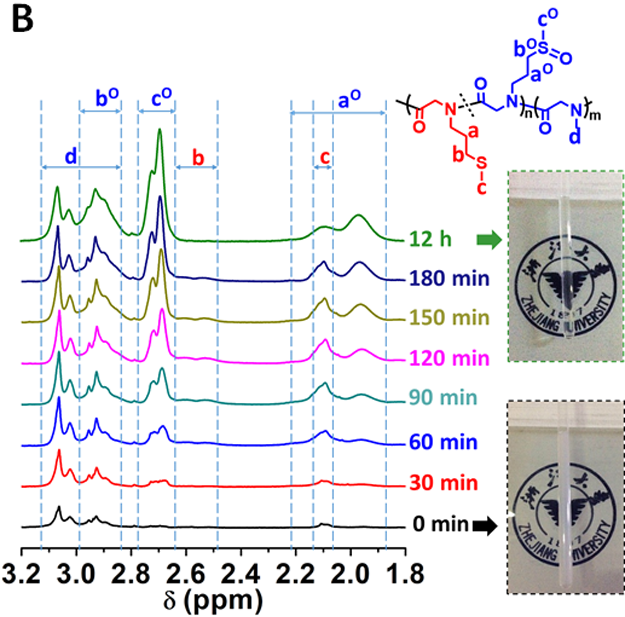
图2. (A)共聚焦显微镜下,一个PMeSPG-b-PSar囊泡在8.8 mM双氧水刺激下随时间的崩解过程。Scale bar = 25 mm。(B)囊泡样品(重水作为溶剂)在H2O2作用下的1H NMR谱图随时间的变化。
在证明了囊泡的氧化响应性后,作者将一种疏水的光敏剂,四苯基卟啉(TPP)引入到PMeSPG-b-PSar囊泡体系中。TPP可通过疏水相互作用附着在囊泡膜上。在光刺激下TPP会生成单线态氧(1O2)等ROS,引起囊泡崩解(图3A)。这样,光作为一种更为可控的刺激源可实现囊泡的响应性行为。如图3B所示,在共聚焦显微镜的激光(HeNe 543 nm)照射下,负载TPP的聚类肽囊泡同样能发生响应性的解散。如图3C所示的虚线内区域经较长时间(15 min左右)的激光集中照射,虚线内的囊泡完全消失,而在其余位置仍有较多的囊泡分布。以1O2氧化为介导,负载TPP的PMeSPG-b-PSar囊泡的响应性崩解可以通过光刺激可控实现。细胞毒性试验结果证明了PMeSPG-b-PSar囊泡具备优良的生物相容性。PMeSPG-b-PSar聚类肽囊泡所展现的这些优异特性使其在药物传递、生物检测、微纳米反应器等应用中具有广阔的应用前景。
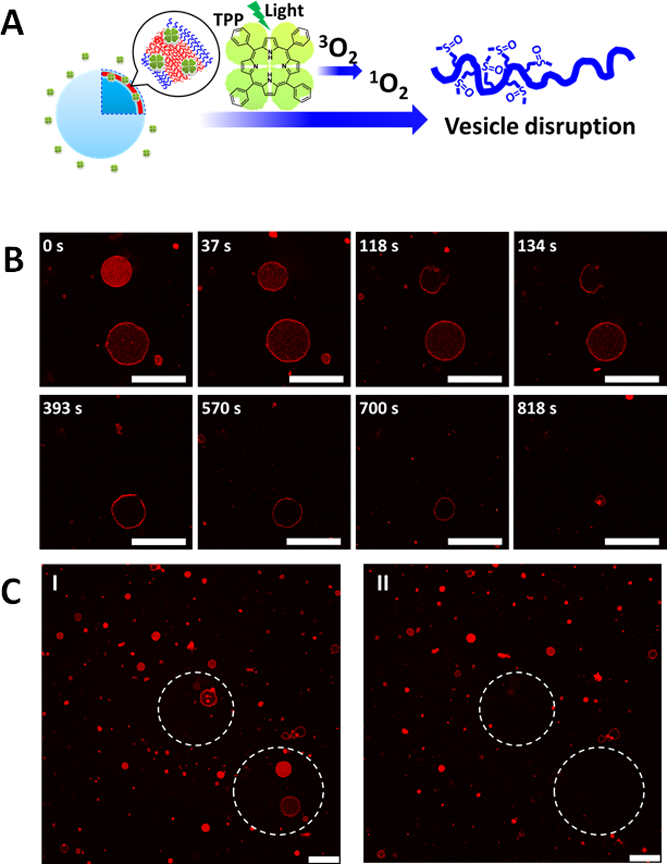
图3. (A) 引入TPP,在光照刺激下激发生成1O2,使得囊泡因氧化响应性而崩解的示意图。(B)两个负载有TPP的PMeSPG-b-PSar囊泡在共聚焦显微镜激光照射下随时间的崩解过程。(C) 在共聚焦显微镜观察中的一区域在长时间的观察实验前(I)和实验后(II)的囊泡分布情况。虚线所示区域均经过共聚焦激光的约15 min集中照射。
以上成果发表在Biomacromolecules (DOI: 10.1021/acs.biomac.9b00713),第一作者是浙江大学博士生邓扬威,他曾作为联合培养博士生到巴黎李敏慧教授课题组进行合作研究。该研究得到法国国家研究基金(ANR)、中国国家自然科学基金、中国留学生基金的资助。
- 吉大陈学思院士、孙静教授团队 JACS:聚类肽辅助因子精准调控熊果酸螺旋纳米纤维原位动态组装实现协同肿瘤增效治疗 2025-05-13
- 巴黎高科化学学院李敏慧教授课题组:红光响应的含钌-多吡啶基配位化合物的聚类肽纳米组装体 2023-12-17
- 北科大姜乃生教授《ACS Macro Lett.》:侧链支化对受限聚类肽薄膜多级晶体结构的影响 2022-08-25
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 华东理工林绍梁/靳海宝团队、上海交大周永丰 Angew:通过调节偶氮苯对位取代基的电子效应制备具有可控光响应性的超薄聚合物囊泡 2025-02-22
- 四川大学丁明明和谭鸿教授团队Angew:高分子构象转变调节囊泡膜通透性 2021-08-19
- 四川大学牛艳华教授/李光宪教授团队《Macromolecules》:弱有序聚离子液体嵌段共聚物的黏弹行为和离子传输特性 2025-12-27
