针对这一挑战,吉林大学陈学思院士和孙静教授研究团队从分子伴侣蛋白的动态调控机制中获得启示,创新性地设计了一种活性聚类肽高分子作为组装辅助因子,聚类肽是一类结构独特的合成高分子,其主链结构与聚肽高分子类似,但不含手性中心且缺乏强氢键作用,这种结构赋予其优异的分子柔韧性和可调控的分子间相互作用,在功能性纳米材料构建中展现出巨大潜力。
研究团队通过模拟生物大分子的精准组装过程,采用生物活性聚类肽电解质调控UA的原位动态自组装,成功构建了具有pH响应特性的螺旋纳米纤维结构(图1)。该自组装过程呈现明显的三阶段演化特征:首先形成纳米级亚结构单元,随后组装为病毒样纳米颗粒,最终自发组织成稳定的螺旋纳米纤维结构(图2)。研究证实,该组装体系的稳定性受到多重因素的协同调控,特别是电荷比、盐浓度、聚合度及溶液pH值等关键参数。值得注意的是,该体系展现出优异的可逆pH响应行为:在中性pH条件下维持稳定的纤维形态,而在酸性环境中则自发转变为病毒样纳米颗粒。这种智能化的形貌转换特性显著提升了纳米载体在肿瘤组织中的渗透效率(图3)。
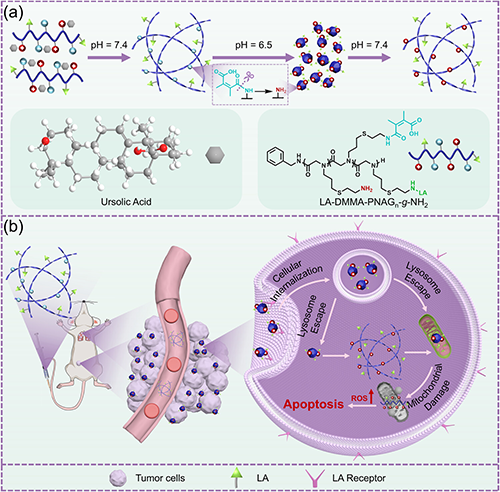
图1. 酸响应性螺旋纳米纤维的制备及抗肿瘤机理。
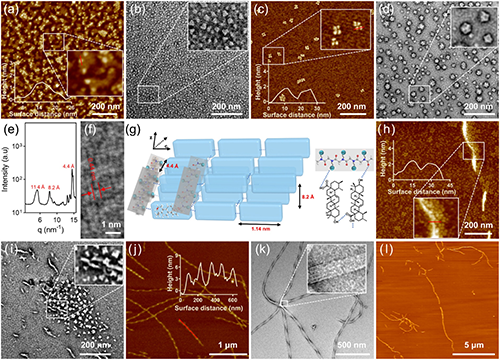
图2. 螺旋纳米纤维的形成过程。
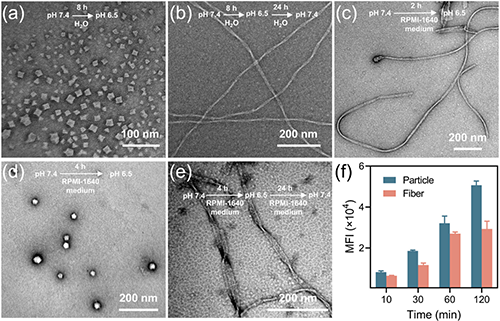
图3. 螺旋纳米纤维的pH响应性。
通过引入酸响应基团和靶向分子乳糖酸(LA),该递送系统实现了多重功能优化:在酸性肿瘤微环境(TME)中高效转变为带正电荷的病毒样纳米颗粒,显著提升肿瘤细胞的特异性摄取(图4);在细胞内实现溶酶体逃逸并靶向线粒体;在高过氧化氢环境下触发药物可控释放,通过诱导线粒体损伤途径诱导细胞凋亡。同时,部分释放组分可在细胞质中重新自组装为纤维状结构,显著延长药物滞留时间(图5)。实验证实,该递送体系展现出优异的协同治疗效果,其抗肿瘤效率显著优于单一疗法,能够有效抑制小鼠肿瘤生长和转移(图6)。
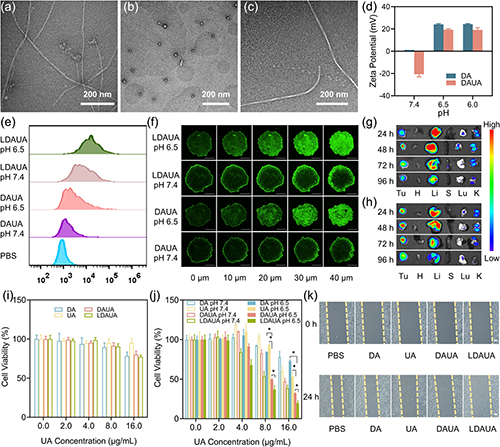
图4. TME响应性纳米药物的性能。
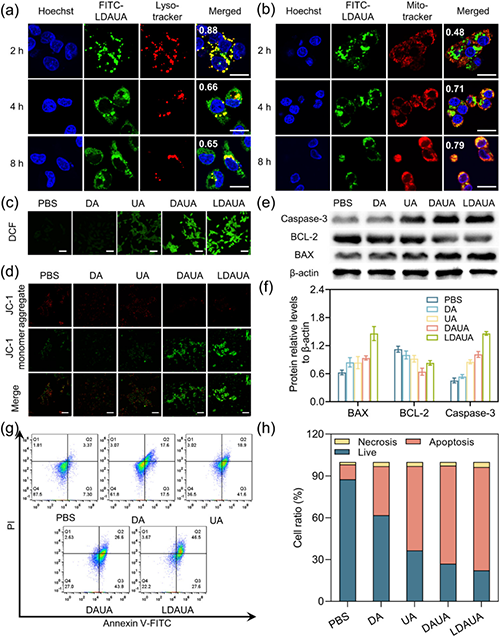
图5. TME响应性纳米药物的抗肿瘤机理。
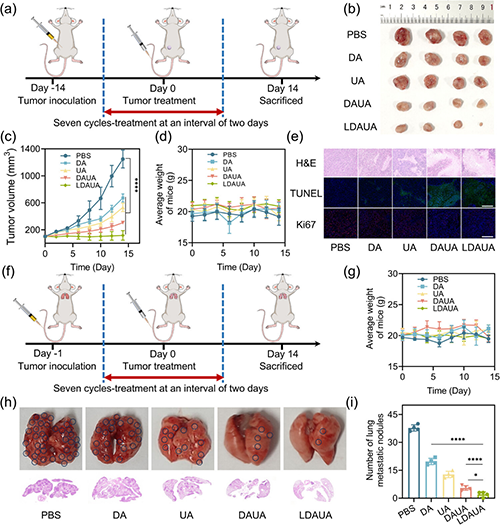
图6. TME响应性纳米药物的体内抗肿瘤和抑制转移能力。
本研究提出的“天然药物-活性聚类肽”仿生组装策略,成功构建了具有pH响应性形貌转换功能的智能纳米纤维载药系统,有效解决了UA临床应用的关键瓶颈。该平台不仅实现了UA的肿瘤靶向递送和可控释放,还通过线粒体损伤机制发挥协同抗肿瘤效应。这一研究为天然产物的纳米医学应用提供了新思路,并有望拓展至其他疏水性抗肿瘤药物的递送系统开发,具有重要的临床转化价值。未来研究可进一步优化聚类肽的分子设计,探索其在联合免疫治疗或靶向-化疗协同中的应用潜力。该工作以“Bioactive Assembly Cofactor-Assisted Ursolic Acid Helix for Enhanced Anticancer Efficacy via In Situ Virus-like Transition”为题发表在《Journal of the American Chemical Society》上,DOI: 10.1021/jacs.5c01214。文章第一作者是吉林大学博士后林敏博士,该研究得到国家自然科学基金委的支持。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.5c01214
- 青科大李志波教授、孙静教授团队系统评述:聚类肽高分子材料及其结构与性能的研究 2018-01-09
- 中山大学吴钧教授课题组《Adv. Funct. Mater.》:在治疗型生物可降解高分子研究中取得新进展 2019-12-28
- 福州大学生命科学与工程学院高纯熊果酸提取技术获成功 2008-12-08
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
