肿瘤内葡萄糖耗竭诱导的癌症饥饿疗法(tumor starvation)代表了抗癌治疗的重要策略,但它通常受到全身毒性,非特异性和平行能量供应的适应性发展的限制。葡萄糖氧化酶(GOx)有效地将葡萄糖氧化成葡萄糖酸和过氧化氢(H2O2),并且已经证明它通过直接葡萄糖消耗在癌症抑制中是有效的。但是,目前仍然存在与此相关的问题。比如,葡萄糖氧化的副产物H2O2会导致DNA损伤和基因突变从而引起全身毒性;正常细胞中葡萄糖的相似代谢需求可引起严重的脱靶效应;癌细胞可以通过其他相似途径获取能量导致饥饿疗法的失败。因此,必须将智能材料设计概念结合到治疗模式中,从而能够有效地消除肿瘤内葡萄糖,具有高特异性和低毒性,用于癌症饥饿治疗。
最近,来自中国科大生命科学学院的王育才教授研究团队在ACS Nano上报道了一种BSA包被的纳米级联簇化酶(BCETPZ@(GOx+CAT)在循环过程中保持稳定,不会引起全身毒性,并且能够在轻度酸性肿瘤微环境中释放GOx和CAT,消耗肿瘤部位葡萄糖同时造成乏氧环境激活乏氧前药,从而实现低毒性肿瘤饥饿并产生局部缺氧以激活化学疗法的协同治疗(图1)。

图1、BCETPZ@(GOx+CAT)在体内的工作原理示意图:(1)白蛋白外壳在循环过程中可以防止酶快速,过早地暴露在血液中;(2)在肿瘤酸性微环境中选择性释放级联酶;(3)GOx消耗肿瘤部位氧气(O2)并造成缺氧环境,产生H2O2和葡萄糖酸,而CAT将产生的H2O2转化为H2O而不会引起全身毒性;(4)步骤3中产生的葡萄糖酸进一步加速纳米簇酶的降解;(5)在缺氧环境中通过还原酶活化乏氧前药BSATPZ,协同葡萄糖消耗肿瘤饥饿疗法。
研究者首先合成嵌段共聚物PEG-b-PHEMACMA,通过酸酐与蛋白的氨基交联制备纳米颗粒,调节聚合物与蛋白的不同比例成功制备具有白蛋白外壳且尺寸约为200 nm的纳米簇化酶。当重量比设定为1:1时,由DLS测量形成尺寸为~600 nm的大聚集体。而当比例增加到5:1时,形成颗粒尺寸~180 nm且分布均一的纳米簇化酶(图2)。研究发现,在pH 7.4的葡萄糖溶液中,BSA的存在可以有效减缓GOx与葡萄糖的接触;在pH 6.5的葡萄糖溶液中,纳米簇化酶可以快速崩解释放原酶。通过粒径表征,溶液中pH变化,溶液中溶解氧和葡萄糖浓度变化成功验证BCE@(GOx+CAT)能够在类肿瘤微酸性环境中选择性地释放原酶,而在中性条件下保持稳定,同时保留了持续消耗O2和葡萄糖的能力(图3)。

图2、纳米簇化酶的大小控制示意图
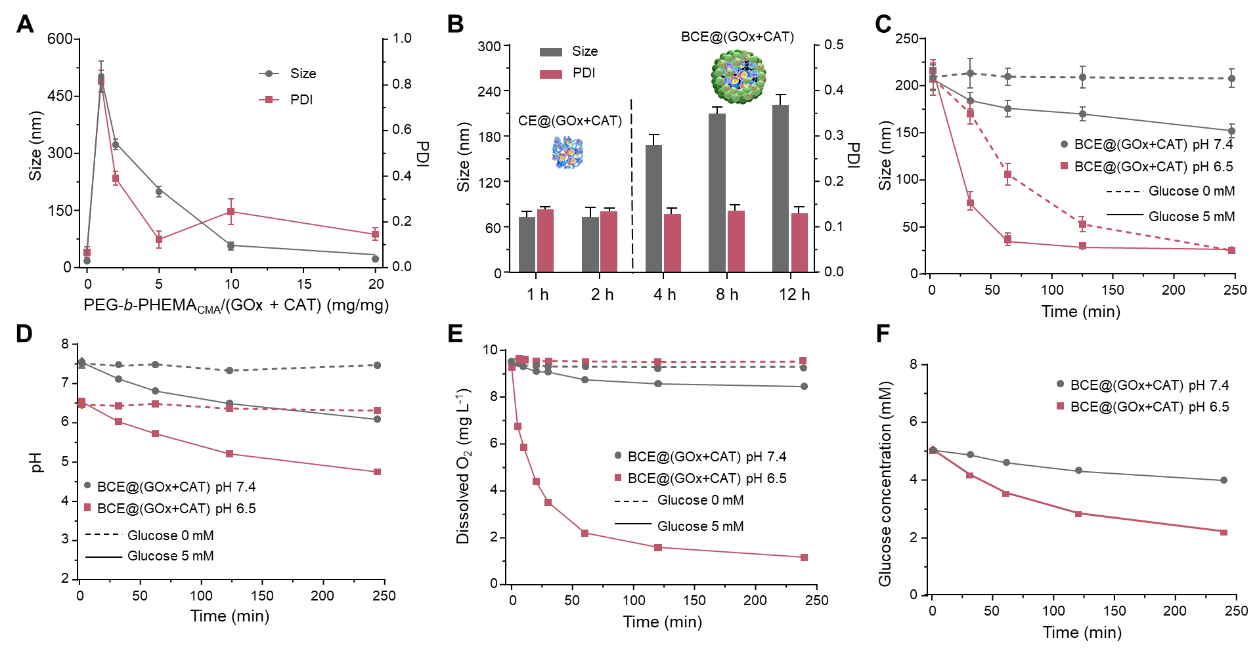
图3、纳米簇化酶的制备和原酶的释放。(A)CE@(GOx+CAT)的粒径分析;(B)在添加BSA前后,纳米簇化酶的粒径分析;BCE@(GOx+CAT)的(C)粒径,(D)pH值,(E)溶解O2和(F)葡萄糖浓度的时间依赖性变化(GOx:2 U/mL,CAT:240 U/mL)。
在验证了纳米簇化酶BCE@(GOx+CAT)在肿瘤中的积累后,他们研究了纳米簇化酶在肿瘤内消耗氧的能力。随着纳米簇化酶静脉注射样品后24小时内,通过乏氧绿色荧光信号的荧光进行观察分析可以看出绿色荧光信号的强度在逐渐增加,表明纳米簇化酶可以迅速消耗肿瘤中的O2,并且,注射后48小时肿瘤内部仍然显示出较强的绿色荧光信号,显示了其持续消耗葡萄糖和氧气的能力。上述结果表明,荷瘤小鼠在静脉注射BCE@(GOx+CAT)后将有效消耗并清除肿瘤内部的O2,导致肿瘤乏氧明显增强(图3)。

图4、(A)注射BCE@(GOx+CAT)后评估肿瘤乏氧程度的示意图。(B)用Hypoxyprobe试剂盒对肿瘤切片进行荧光染色的代表性免疫荧光图像。
该研究成功展示了一种通过结合靶向肿瘤饥饿和脱氧激活化疗来强化癌症治疗的级联催化纳米药物的方法。纳米药物在血液循环过程中保持稳定并仅在肿瘤微酸环境释放原酶快速耗尽肿瘤细胞中的葡萄糖和O2,实现低毒性的肿瘤的饥饿疗法,并产生局部缺氧来激活化疗。这一策略提供了一个创新的肿瘤饥饿和脱氧激活化疗的协同治疗设计方式,从而提高抑制肿瘤效果。
中国科大博士生马寅初、赵阳阳与博士后纳文博士为本论文共同第一作者,王育才教授为本文的通讯作者。
该工作得到了国家自然科学基金(NOs. 51773191, 51573176, 51633008),国家重点研发计划(2017YFA0205600)的资助。
论文题目为“Nanoclustered Cascaded Enzymes for Targeted Tumor Starvation and Deoxygenation-Activated Chemotherapy without Systemic Toxicity”
- 四川大学牛艳华教授/李光宪教授团队《Macromolecules》:弱有序聚离子液体嵌段共聚物的黏弹行为和离子传输特性 2025-12-27
- 华南理工大学王林格教授团队 Small:时间分辨小角 X 射线揭示聚合诱导自组装两嵌段共聚物胶束的生成机制 2025-09-09
- 天津大学潘莉教授团队 CEJ:具有双晶网络的乙烯-丙烯嵌段共聚物 - 高性能弹性体及HDPE/iPP共混物的升级回收 2025-07-20
- 福大林立森/新国大陈小元 Nature大子刊:当手性水凝胶遇上细胞膜仿生-可术后空腔植入的生物杂化水凝胶如何调节肿瘤干细胞信号 2025-12-30
- 苏州大学冯良珠教授、刘庄教授团队 AFM:温敏催化水凝胶助力酶触“破膜+氧化应激”级联肿瘤消融新策略 2025-12-04
- 四川大学丁明明/薛建新《Adv. Mater.》:铜驱动变构自封装聚合物用于肿瘤特异性成像和治疗 2025-10-13
- 海南大学郭东波/陈茂华团队 AFM:一种无需药物的神奇疗法 - 体温引发聚合的放热水凝胶用于收缩驱动的肿瘤饥饿疗法 2025-08-11
