代谢重编程是癌症的一大特征。在此过程中,癌细胞过度表达的缺氧诱导因子-1α会促进乳酸脱氢酶和丙酮酸脱氢酶激酶的表达。乳酸作为一种重要的代谢产物在肿瘤微环境(TME)中蓄积,通过诱导免疫抑制和削弱免疫细胞的功能,促进恶性肿瘤的侵袭和转移。因此,降低TME中的乳酸水平是增强抗癌免疫反应的有效策略。
与葡萄糖代谢有关的天然酶,如葡萄糖氧化酶、己糖激酶和乳酸氧化酶(LOx),是具有良好的生物相容性和高度特异性的催化剂,可直接消耗癌症的关键代谢产物和能量来源。最近,针对乳酸调节的癌症代谢疗法备受关注,特别是LOx能将TME中的乳酸转化为丙酮酸和过氧化氢(H2O2),从而直接消耗TME中的乳酸水平。然而,天然酶(如LOx)缺乏理想的稳定性,不利于细胞吸收和体内应用。因此,开发一种有效递送LOx的纳米药物以增强抗癌免疫治疗至关重要。
在各种纳米材料中,树状大分子,尤其是聚酰胺-胺(PAMAM)树状大分子,因其独特的物理化学和结构特性而备受关注。根据以往的研究,苯硼酸(PBA)修饰的PAMAM树状大分子能够有效地在细胞内输送蛋白质/酶和遗传物质(ACS Nano 2023, 17, 23889?23902)。根据课题组之前的研究显示,PAMAM树状大分子可通过表面修饰的吡啶(Pyr)配体与Cu(II)配位,从而促进肿瘤磁共振成像和基于类芬顿反应的高效活性氧(ROS)生成(Nano Today 2021, 41, 101325;Nano Today 2020, 33, 100899;Nano Lett. 2019, 19, 1216?1226)。据推测,Cu(II)/树状大分子络合物可被开发为一种递送LOx的载体系统,通过对肿瘤进行联合代谢干预和CDT,进而大大提高抗肿瘤疗效。
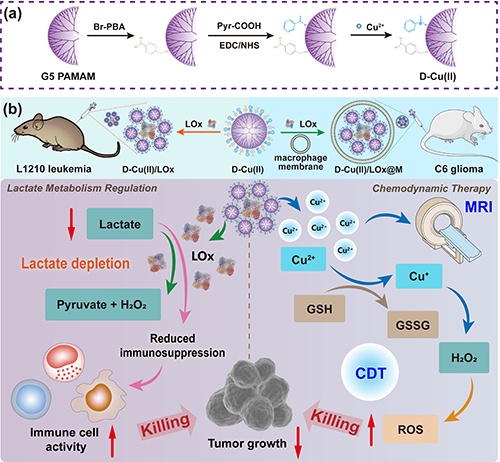
图1.(a)D-Cu(II)复合物的合成和(b)治疗L1210白血病和C6胶质瘤的作用机制。
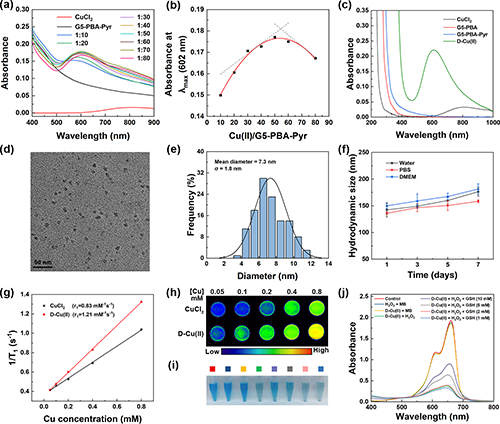
图2.(a)CuCl2、G5-PBA-Pyr和D-Cu(II)在不同G5 PAMAM/Cu(II)摩尔比下的紫外可见光谱;(b)602 nm处的紫外可见吸光度随Cu(II)/ G5 PAMAM摩尔比变化的拟合曲线;(c)CuCl2、G5-PBA、G5-PBA-Pyr和D-Cu(II)在水溶液中的紫外可见光谱;(d)D-Cu(II)复合物的TEM图片和(e)粒径分布直方图;(f)D-Cu(II)分别分散在水、PBS和DMEM中一周内的水动力尺寸;(g)CuCl2或D-Cu(II)在不同Cu浓度下的1/T1线性拟合和(h)MR伪彩图;(i)MB、H2O2和D-Cu(II)混合后在不同GSH浓度下于37 ℃作用4 h的照片和(j)紫外吸收曲线。

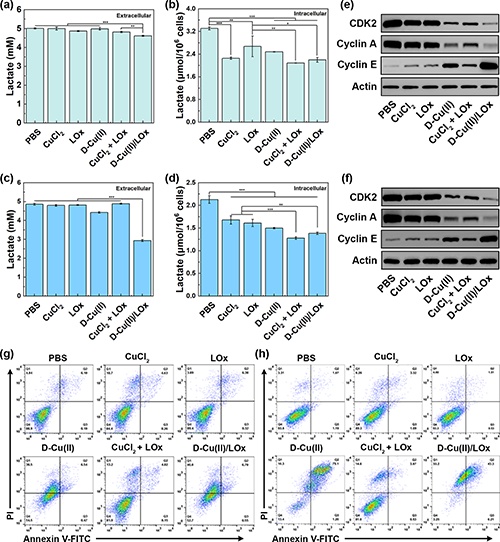
图3.(a)以L1210小鼠白血病细胞和C6胶质瘤细胞为模型,体外检测D-Cu(II)/LOx复合物的抗癌性能;(b)L1210和(c)C6细胞在不同Cu浓度的CuCl2、D-Cu(II)或D-Cu(II)/LOx处理后的细胞活力;(d)L1210和(e)C6细胞在不同处理后的细胞内LPO水平;(f)L1210和(g)C6细胞在不同处理后的细胞内ROS水平。
按照图5a所示的时间表检测树状大分子递送系统联合LA-1在L1210白血病模型中的体内治疗效果。L1210白血病恶性程度高,能在短时间内使小鼠产生大量腹水。腹水在腹腔内积聚导致白血病小鼠体重增加(图5b),小鼠存活率(图5c)显示癌症进展得到缓解。白血病以肝脾为主要受累脏器,以肝脾肿大为主要症状,结果显示,肝脏(图5d)和脾脏(图5e)负担均有一定减轻。通过检测小鼠腹水中的乳酸水平,发现D-Cu(II)/LOx + LA-1处理导致细胞内(图5f)和细胞外(图5g)乳酸含量的最显著降低。与PBS组相比,D-Cu(II)/LOx + LA-1组白细胞(WBC)水平显著降低(图5h),表明D-Cu(II)/LOx + LA-1联合治疗可以有效缓解白血病症状。
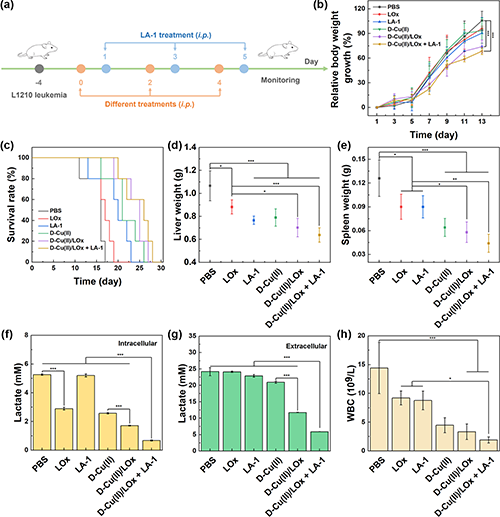
图5.(a)L1210白血病治疗方案示意图;L1210白血病小鼠的(b)相对体重、(c)存活率、(d)肝脏重量和(e)脾脏重量;小鼠腹水中(f)细胞内和(g)细胞外乳酸含量;(h)L1210白血病小鼠白细胞检测。
通过Wright-Giemsa染色检测外周血白血病细胞水平(图6a),D-Cu(II)/LOx + LA-1组在外周血中显示出最明显的白血病细胞减少效果。同时,从图6b和图6d可以看出,D-Cu(II)/LOx + LA-1组小鼠骨髓内CD38荧光强度最低,表明骨髓内白血病细胞浸润减少。同时,D-Cu(II)/LOx + LA-1组骨髓中的MDSCs细胞积累减少(图6c)。T细胞介导的免疫反应对抑制白血病细胞的生长具有重要作用。因此,他们研究了小鼠脾脏中效应T细胞的比例。与其他组相比,D-Cu(II)/LOx + LA-1组的CD4+(图6e)和CD8+(图6f)T细胞均显著上调,同时,Tregs细胞明显减少(图6g),显示出T细胞活性增强。骨髓细胞中M2 TAM(图6h)和MDSC(图6i)细胞浸润百分比显著降低,表明D-Cu(II)/LOx + LA-1联合治疗可有效缓解体内免疫抑制。
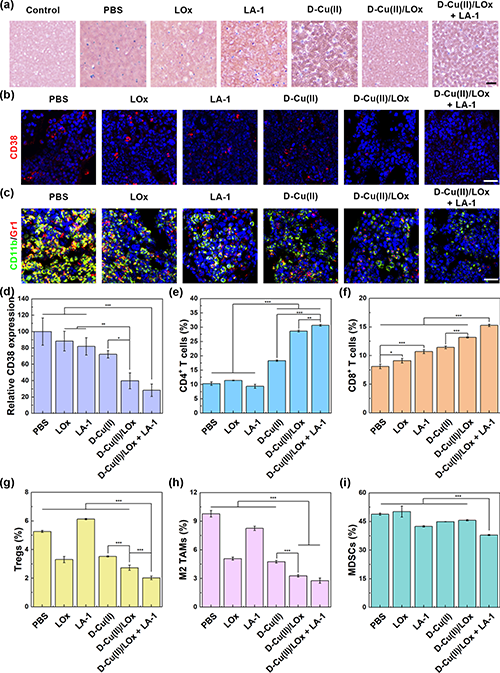
图6.(a)L1210白血病小鼠在不同处理下的血样Wright-Giemsa染色;(b)小鼠骨髓切片CD38和(c)CD11b/Gr1的免疫荧光图像;(d)小鼠骨髓中CD38的相对表达量;(e)小鼠脾脏中CD4+ T细胞、(f)CD8+ T细胞和(g)Tregs的比例;(h)小鼠骨髓中M2 TAM和(i)MDSC的比例。
接下来,他们继续在原位脑胶质瘤模型中检查纳米递送系统的治疗效率。在活体(图7a-b)和离体(图7c)荧光图像中,可以清楚地观察到D-Cu(II)/Cy5.5-LOx@M组中红色荧光信号的积累增强,这表明巨噬细胞膜涂层使纳米系统具有优异的BBB穿越性能。在原位胶质瘤小鼠模型中测试D-Cu(II)/LOx和D-Cu(II)/LOx@M的体内T1加权MR成像性能(图7d-e),表明开发的D-Cu(II)/LOx@M是一种有效的MR成像造影剂,可用于原位脑胶质瘤的诊断。

图7.(a)不同时间点的体内荧光成像和(b)脑内平均辐射效率;(c)主要器官的离体荧光成像;(d)体内脑胶质瘤T1加权MR成像(肿瘤部位用红色虚线圈表示)和(e)信噪比。
接下来,团队在C6原位脑胶质瘤模型(图8a)中评估树状大分子递送平台联合LA-1治疗的体内抗肿瘤功效。通过T1加权MR成像实时监测不同处理后小鼠肿瘤的相对体积变化(图8b)。定量分析表明,肿瘤生长均可受到不同程度的抑制(图8c),大大延长小鼠的总生存时间(图8d),减轻小鼠的快速体重下降(图8e)。从H&E染色(图8f)结果中可以清楚地看到,最后两组的肿瘤生长明显受到抑制。通过对胶质瘤局部TME的分析发现,最后两组M2 TAM(图8g)和MDSCs(图8h)细胞的积累减少,CD8+T(图8i)细胞的浸润增加,Ki67水平明显降低(图8j)。

图8.(a)C6原位胶质瘤模型建立及治疗方案;(b)第1、4、7天的代表性MR图像;(c)小鼠的定量RTV、(d)存活率、(e)体重;(f)第11天小鼠脑切片的代表性H&E染色;(g)F4/80/CD206、(h)CD11b/Gr1和(i)CD8的代表性免疫荧光染色图;(j)Ki67定量分析结果。
简而言之,他们开发了功能化D-Cu(II)复合物递送LOx,用于乳酸代谢干预、CDT和T1加权MR成像,从而有效地治疗癌症,并且可以通过结合免疫激动剂LA-1来增强免疫反应。这种基于树状大分子的纳米药物D-Cu(II)/LOx可以有效缓解小鼠白血病的症状,并在MR成像引导下,通过包覆巨噬细胞膜(D-Cu(II)/LOx@M)穿越BBB治疗小鼠原位脑胶质瘤模型。重要的是,在这两种癌症模型治疗中,他们证明了树状大分子平台结合LOx介导的乳酸消耗和Cu(II)介导的CDT,小鼠的总生存时间和抗肿瘤免疫反应得到改善,重塑免疫抑制性TME,极大地敏化了免疫激动剂LA-1的治疗效果,从而增强抗肿瘤免疫反应。本研究制备的D-Cu(II)/LOx为协同化学动力学治疗和代谢干预治疗进而实现增强的抗肿瘤免疫治疗提供了新思路。
以上研究成果以“Dendrimer-Cu(II) Complexes Mediate Enzyme Delivery for Lactate Depletion-Enhanced Combinational Treatment of Leukemia and Glioma”为题,在线发表于国际著名期刊Advanced Functional Materials (DOI: 10.1002/adfm.202420825)。东华大学生物与医学工程学院沈明武研究员/史向阳教授和白俄罗斯国家科学院生物物理与细胞工程研究所Dzmitry Shcharbin教授为共同通讯作者,博士研究生李爱雨为第一作者。该工作得到了国家重点研发计划、国家自然科学基金委、上海市科委及白俄罗斯基础研究基金会等项目的资助。
文章链接:https://doi.org/10.1002/adfm.202420825
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学史向阳教授团队:外泌体包裹的响应性树状大分子纳米凝胶可实现急性肺损伤的免疫调节和抗氧化联合治疗 2025-05-15
- 苏州大学刘庄教授团队:肿瘤微环境响应性的透明质酸酶递送体系增强光动力/免疫联合治疗 2019-05-27
- 加州大学洛杉矶分校顾臻教授团队:“联合细胞递药”治疗白血病 2018-10-31
- 东华大学史向阳教授 Nano Today:仿生金属-多酚网络包覆弹性蛋白样多肽胶束实现原位脑胶质瘤的声动力/化学动力/免疫治疗 2025-05-28
- 无线植入设备实现脑肿瘤精准治疗 - 中山大学徐炳哲团队突破胶质瘤治疗难题 2024-12-15
