胶质瘤作为中枢神经系统极具侵袭性的肿瘤,因高侵袭性、遗传异质性和血脑屏障(BBB)保护,传统疗法效果欠佳。声动力疗法(SDT)以其无创、深层组织穿透等优势成为新兴治疗方式,通过超声激活声敏剂产生单线态氧破坏肿瘤细胞,同时利用声空化效应增强药物渗透。但小分子声敏剂存在体内代谢快、选择性差等问题,限制了疗效。尽管纳米载体系统整合声敏剂有所改进,但能穿过BBB实现胶质瘤协同治疗的载体设计仍具挑战。
弹性蛋白样多肽(ELPs)作为模拟天然弹性蛋白的人工多肽,凭借生物相容性好、免疫原性低、热响应性及可被蛋白酶降解等优势,在生物医学领域备受关注。ELPs由VPGXG五肽单元构成,可通过序列定制实现对温度、pH和光等刺激的响应,其自组装行为使其能负载疏水药物,延长药物血液循环时间和提高药物生物利用度。而多酚与金属离子配位形成的金属酚网络(MPNs)在肿瘤化学动力学治疗(CDT)和磁共振(MR)成像中展现潜力,特别是单宁酸/Mn2?(TM)MPNs,具有生物相容性、pH敏感性和CDT性能。其丰富的酚羟基使其可作为涂层材料吸附于纳米材料上。此外,研究表明活性氧(ROS)除直接杀伤肿瘤细胞外,还可通过诱导免疫原性细胞死亡(ICD)和激活cGAS-STING通路触发抗肿瘤免疫。Mn2?能增强cGAS对DNA的敏感性及cGAMP与STING的亲和力,协同CDT/SDT有效激活抗肿瘤免疫反应。
基于此,东华大学史向阳教授团队与法国波尔多大学Sébastien Lecommandoux教授课题组合作设计并构建了一种巨噬细胞膜仿生的金属-多酚网络包覆弹性蛋白样多肽胶束用于实现原位脑胶质瘤的声动力/化学动力/免疫治疗(图1)。研究团队以分子量为33.7kDa、氨基酸序列为MW[VPGVG-VPGMG-(VPGVG)2]20的ELP通过共价键与声敏剂二氢卟吩e6(Ce6)链接,并在水溶液中通过自组装形成纳米胶束,随后包覆由单宁酸和Mn2+组成的MPN,从而获得Ce6-ELP@TM。最后,Ce6-ELP@TM被巨噬细胞膜(MMs)伪装获得纳米药物Ce6-ELP@TM/MM。该纳米药物的物理化学特性、体外及体内的抗肿瘤效果、免疫激活效果及相关机制被详细评价。
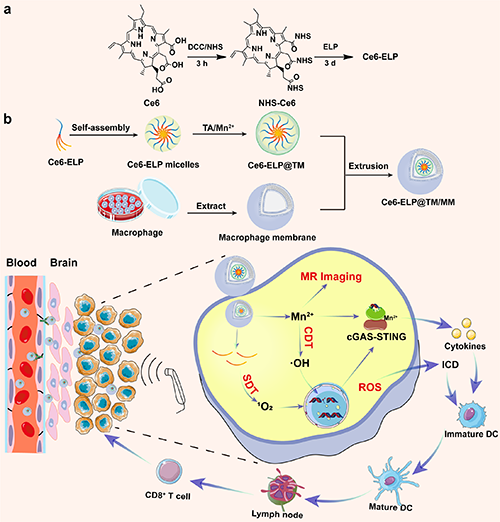
图1. Ce6-ELP共聚物的合成(a)及Ce6-ELP@TM/MM的制备和用于原位脑胶质瘤治疗示意图(b)。
团队首先通过1H NMR、荧光光谱、动态光散射、圆二色谱、TEM等证明了Ce6-ELP@TM/MM的成功制备,且具有良好的胶体稳定性及声动力学特性,其平均尺寸约为58 nm(图2)。
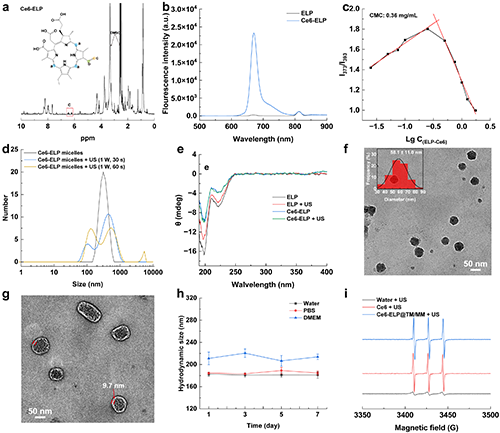
图2.(a)Ce6-ELP在氘化DMSO中的1H NMR谱。(b)ELP和Ce6-ELP的荧光发射光谱(激发波长 = 405 nm)。(c)用芘作为荧光探针测定得到的Ce6-ELP纳米胶束的CMC。(d)不同处理后Ce6-ELP纳米胶束的水动力尺寸分布。(e)超声辐照前后ELP或Ce6-ELP的圆二色谱。(f-g)Ce6-ELP@TM(插图为Ce6-ELP@TM的尺寸分布直方图)和Ce6-ELP@TM/MM的TEM图像(比例尺为50 nm)。(h)Ce6-ELP@TM/MM分散在水中、PBS或含有10% FBS的DMEM中的水动力学尺寸(n = 3)。(i)在超声辐照后的TEMP捕获的1O2的ESR谱图([Ce6] = 5 μg/mL, 1.0 MHz, 1.0 W/cm2, 30 s)。
随后,团队通过流式细胞术和激光共聚焦分析了肿瘤细胞对Ce6-ELP@TM/MM的摄取行为,并以CCK-8法初步评估了纳米药物的体外抗肿瘤效果(图3),并以此结果确定了后续实验中超声施加的条件及药物使用浓度。
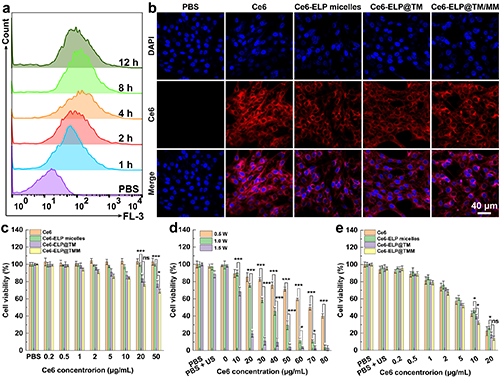
图3. (a)C6细胞与Ce6-ELP@TM/MM培养不同时间后的流式细胞术检测结果(n = 3)。C6细胞与不同材料孵育4小时后的激光共聚焦图像(b,比例尺为40 μm)。(c)在没有超声的情况下,C6细胞与不同材料培养24小时后的活力(n = 6)。(d)在不同条件下,Ce6与C6细胞共培养后经不同条件超声照射(1 MHz)的活力(n = 6)。(e)不同材料与C6细胞共培养后在超声照射下的细胞活力(1 MHz、1 W/cm2和40 s,n = 6)。在图c-e中,ns表示无统计学差异,*表示p < 0.05,***表示p < 0.001。
接下来,团队深入研究了Ce6-ELP@TM/MM对C6细胞的详细治疗机制。通过细胞活死染色、细胞凋亡以及细胞内的ROS、线粒体膜电位等的检测证实了,该纳米药物的化学动力学和声动力学治疗效果(图4)。以蛋白质免疫印迹分析评估了癌细胞经纳米药物处理后,细胞内的STING通路的激活状态,证明了Mn2+在细胞STING通路激活过程中的作用。
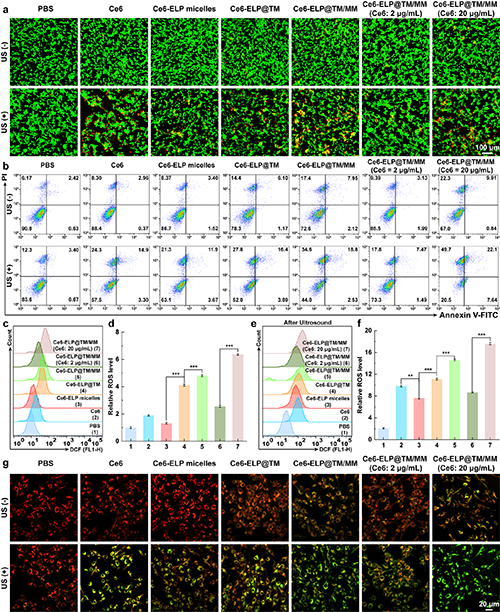
图4.(a)不同材料处理C6细胞在超声存在或不存在条件下的活、死染色结果(比例尺= 100 μm)。(b)经不同处理后的C6细胞的凋亡流式细胞术分析(n = 3)。(c-f)经不同处理的C6细胞内ROS水平变化的流式细胞检测结果及定量分析(n = 3)。(g)经不同处理后的C6细胞内的线粒体膜电位变化检测结果(比例尺= 20 μm,1 W/cm2, 30 s, 1 MHz)。在图d和f中,**表示p < 0.01,***表示p < 0.001。
团队进一步研究了纳米药物在超声辐照下诱导免疫源性细胞死亡的效果。通过胞外ATP和HMGB-1研究及激光共聚焦显微镜观察表明,超声辐照下,纳米药物能够导致ATP分泌及HMGB-1释放增加(图5b-c),同时能引起胞内大量的CRT外翻至细胞膜上(图5d),从而说明其可在体外诱导癌细胞发生免疫原性死亡。随后,Transwell实验证明了引起的ICD能够引起树突细胞熟化(图5e)。
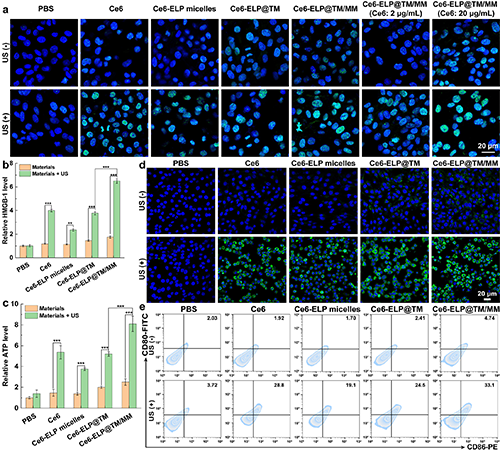
图5.(a)经不同材料处理后C6细胞内γ-H2AX的免疫荧光染色结果。不同处理后C6细胞释放ATP(b)、HMGB1的水平(c)和C6细胞膜表面暴露CRT的水平(d);不同处理的C6细胞与树突细胞共孵育示意图及树突细胞熟化情况(e);在图c-d中,**表示p < 0.01,***表示p < 0.001。
该纳米药物携带的Mn2+和Ce6分别具备MR成像和荧光成像的特性,通过对巨噬细胞膜仿生前后的纳米药物在脑部聚集情况的分析,验证了Ce6-ELP@TM/MM能够跨越血脑屏障实现高效的脑部递送(图6)。
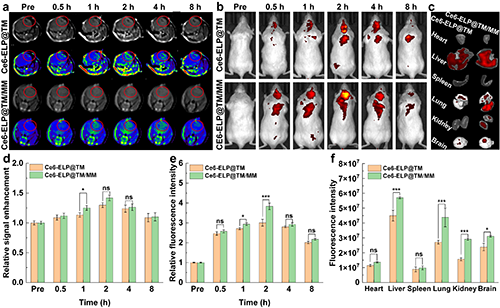
图6.(a)尾静脉注射Ce6-ELP@TM或Ce6-ELP@TM/MM前后不同时间点后的原位脑胶质瘤小鼠模型的T1加权MR图像。(b)尾静脉注射不同时间点后原位脑胶质瘤小鼠模型的体内和(c)离体器官荧光图像。不同处理组荷瘤小鼠的胶质瘤MR信号强度定量分析(d)、荧光强度分析(e)和离体主要器官荧光强度分析(f)([Ce6] = 5 mg/kg,每只小鼠200 mL PBS,n = 3)。在图d-f中,ns表示无统计学差异,*表示p < 0.05,***表示p < 0.001。
随后,团队通过建立C6原位脑胶质瘤模型,研究了Ce6-ELP@TM/MM的体内抗肿瘤治疗效果。实验结果表明,相同材料处理后,施加超声明显增强了治疗效果,大大抑制了肿瘤的生长,这表明声动力治疗联合化学动力学治疗后比单一的化学动力学治疗效果更佳(图7)。通过免疫组化和免疫荧光切片进一步验证了纳米药物的体内治疗效果及其在体内对STING的激活情况。
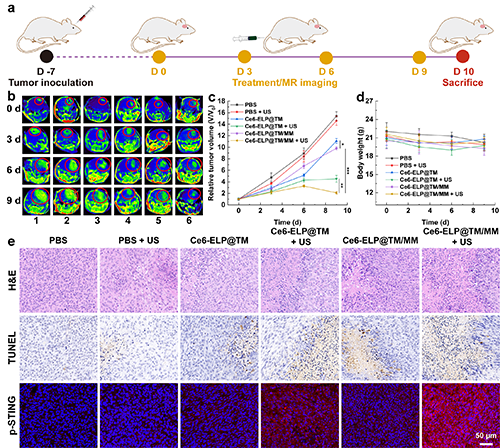
图7.(a)Ce6-ELP@TM/MM纳米复合物的荷瘤小鼠体内治疗过程示意图;(b)不同治疗组的代表性MR图像(1:PBS;2:PBS + US;3:Ce6-ELP@TM;4:Ce6-ELP@TM + US;5:Ce6-ELP@TM/MM;和6:Ce6-ELP@TM + US)以及不同处理后各组相对肿瘤体积(c)和小鼠体重(d)定量分析(c-d组,n = 5)。(e)肿瘤的免疫组织化学(H&E和TUNEL)和免疫荧光染色(p-STING)结果(标尺为50 μm)。在图c中,*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
随后,团队研究了Ce6-ELP@TM/MM纳米药物介导的联合治疗后的体内免疫响应。结果表明,Ce6-ELP@TM/MM在施加超声后,肿瘤和脾脏CD4+T细胞和CD8+T细胞的数量上调最为明显,肿瘤部位的调节性T细胞(Tregs)显著下调,证明通过声动力/化学动力/免疫联合治疗后能够有效刺激机体产生更多的杀伤和效应性T细胞,从而增强抗肿瘤治疗效果(图8)。
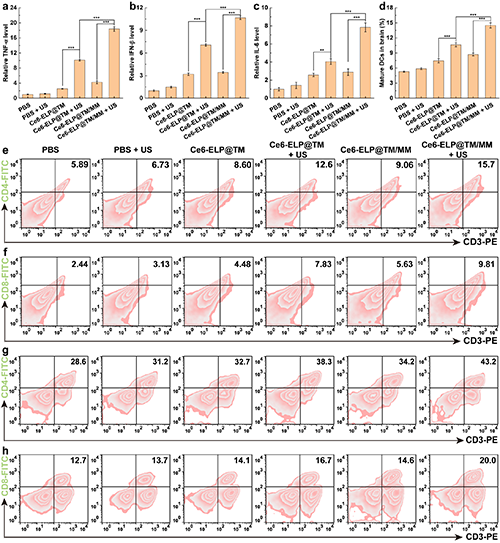
图8. 不同处理后血清中TNF-α(a)、IFN-β(b)、IL-6(c)的相对水平(n = 3)。不同处理后脑内CD11c+CD80+DC的百分比(n = 3)(d)。(e)不同处理后脑内CD3+CD4+ T细胞和(f)CD3+CD8+ T细胞的流式细胞分析结果(n = 3)。(g)不同处理后脾脏CD3+CD4+ T细胞和(h)CD3+CD8+ T细胞的流式细胞分析结果(n = 3)(a-d组中,**表示p < 0.01,***表示p < 0.001)。
以上研究以“Biomimetic metal-phenolic network-coated elastin-like polypeptide micelles as an immunogenic cell death inducer for orthotopic glioma sonodynamic-chemodynamic-immune therapy”为题,发表于国际著名期刊Nano Today上。东华大学生物与医学工程学院博士研究生王志强为第一作者,东华大学史向阳教授为通讯作者。该工作得到了国家自然科学基金委、上海市科委等项目的资助。
原文链接:https://doi.org/10.1016/j.nantod.2025.102810
- 烟台大学陈大全教授团队:结合中医药引经理论,构建基于桔梗多糖的巨噬细胞膜仿生纳米载体用于靶向肺炎以及平息细胞因子风暴 2022-02-11
- 东华大学史向阳教授课题组《ACS Nano》:巨噬细胞膜仿生的多功能纳米凝胶用于MR成像引导的原位脑胶质瘤联合治疗 2021-12-06
- 四川大学高会乐教授课题组Biomaterials:巨噬细胞膜包被的激光响应性纳米递药系统用于肿瘤的免疫治疗 2020-06-23
- 南京大学王炜/曹毅/薛斌团队 Nat. Commun.:仿生分级picot纤维水凝胶涂层实现超低摩擦与高耐磨性 2026-02-09
- 武汉大学刘兴海教授团队《Small》:仿生超韧快速响应水凝胶 2026-02-02
- 仿生“阴阳耦合”+ 多尺度纳米限域效应!上海交大黄小彬团队 AFM:研发高性能光热滑爽聚脲防除冰涂层-为户外设备抗冰提供新思路 2026-01-31
- 东南大学葛丽芹教授课题组 Small:在微气泡上组装金属-多酚网络一步制备功能性超薄微胶囊 2023-08-30
