纳米医学是生物医学的一个相对较新的领域,开发可降解的高效药物传递系统(DDS)成为一个热门的研究课题。光刺激的DDS可远程激活、时间和空间高度精确。邻硝基苄酯(ONB)给予一定光照后,可以发生不可逆光化学反应;在紫外光下,PONB的DDS系统可发生降解,释放药物的同时,裂解产物被排出体外,既满足了高效的控制释放需求,同时具有较低的生物毒性。然而,ONB基团只对紫外光敏感,且空间位阻较大。目前,主要通过胶束的方法构建紫外光响应的邻硝基苄基DDS。而胶束结构不牢固,且紫外光组织穿透性差,生物毒性大,限制了其在生物体的应用。近红外光对组织损伤小,穿透性强。稀土上转换纳米粒子可利用近红外光激发将能量上转换而发出紫外光的特性可激发邻硝基苄裂解实现控制释放,有望解决光响应DDS迫在眉睫的问题。
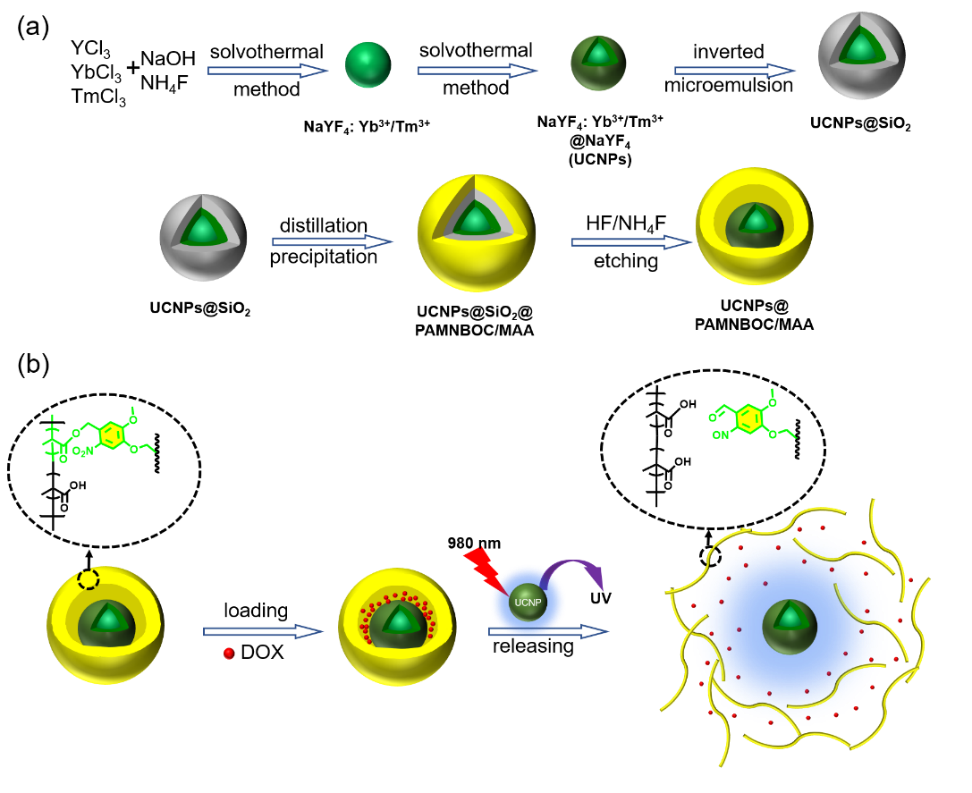
图1(a)纳米胶囊的合成路线和(b)药物在纳米胶囊上的负载和释放紫外光谱。
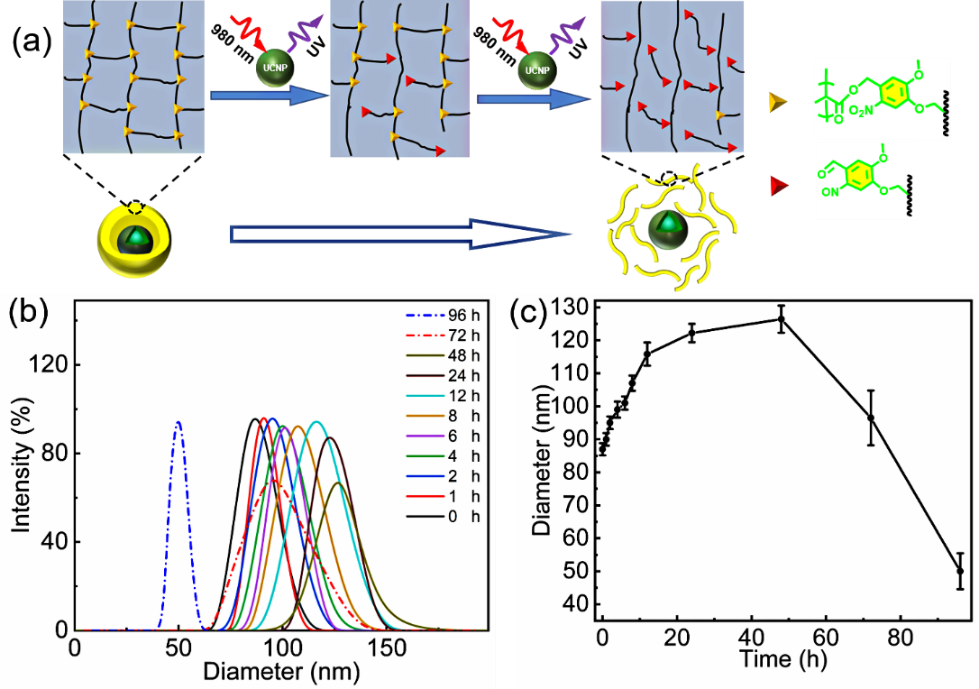
图2(a)UCNPs@PAMNBOC/MAA 纳米胶囊的聚合物壳随着光照时间的增加而发生的降解过程;(b)不同NIR照射时间后的DLS曲线;(c)UCNPs@PAMNBOC/MAA纳米胶囊粒径随光照时间的变化曲线。

通过细胞摄取实验证明纳米胶囊能够被MCF-7细胞有效内化,并通过添加不同的内吞抑制剂研究其内化机理,结果表明纳米胶囊是通过小窝蛋白介导的内吞途径进入细胞中。进一步,对纳米胶囊处理MCF-7进行了不同条件下的实验。没有纳米胶囊的对照组和NIR组呈现较高的细胞存活率,证明NIR照射对细胞是生物友好的。游离的DOX组呈现较少的细胞存活率,表明化疗药物产生了更大的细胞毒性。而空白纳米胶囊及其光解副产物对MCF-7细胞具有低毒性。载药后纳米胶囊在近红外光作用下呈现较低的细胞存活率,证明近红外辐射刺激是控制DOX-UCNPs@PAMNBOC/MAA纳米胶囊释放DOX并诱导细胞凋亡的有效方法。
论文链接:https://doi.org/10.1021/acs.biomac.2c01404
- 山东大学崔基炜教授/山西大学冯丽恒教授 ACS Nano:硬度可调的超分子纳米胶囊用于NIR-II荧光成像引导的细菌感染治疗 2026-02-11
- 东华大学史向阳教授团队 AFM:微流控合成无载体全活性的金属酚纳米胶囊用于肿瘤的化疗-化学动力学治疗-免疫治疗 2024-12-02
- 青岛大学于涛和亓洪昭团队《ACS AMI》:多阶段响应型纳米复合物通过改善口服核酸药物在结肠内的蓄积和分布来减轻溃疡性结肠炎 2022-04-08
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
