铁死亡作为一种新型非凋亡性细胞死亡途径,可通过破坏细胞内氧化还原稳态,有效增强光动力治疗(PDT)的抗肿瘤效果,为开发抗肿瘤纳米制剂提供了新方向。然而,PDT结合铁死亡的纳米复合材料制备过程复杂,且不利的肿瘤微环境会严重干扰PDT和铁死亡的抑瘤作用。为了解决PDT和铁死亡有效结合的问题,科研人员致力于探索能够激活铁死亡途径的光敏剂。
受益于铁蛋白的参与,所制备的仿生纳米晶体不仅为氧依赖性PDT提供了充足的氧气,还为铁依赖性铁死亡提供了Fe3+。通过对比细胞活性,ROS表达水平及结构特征,表明AE@RBC/Fe NCs可以诱导口腔鳞癌细胞(HSC-3)发生铁死亡,并在光辐射条件下进一步实现更有效的PDT和铁死亡协同作用(图3)。基于红细胞膜对AE 纳米晶体的仿生修饰,AE@RBC/Fe NCs可以在体内逃避免疫清除,明显提高其在肿瘤部位的积累,具有明显的肿瘤抑制效果(图4)。AE@RBC/Fe NCs制备简单且抗肿瘤效果突出,有利于铁死亡和PDT协同治疗策略在治疗口腔鳞癌等浅表肿瘤领域的实际转化。
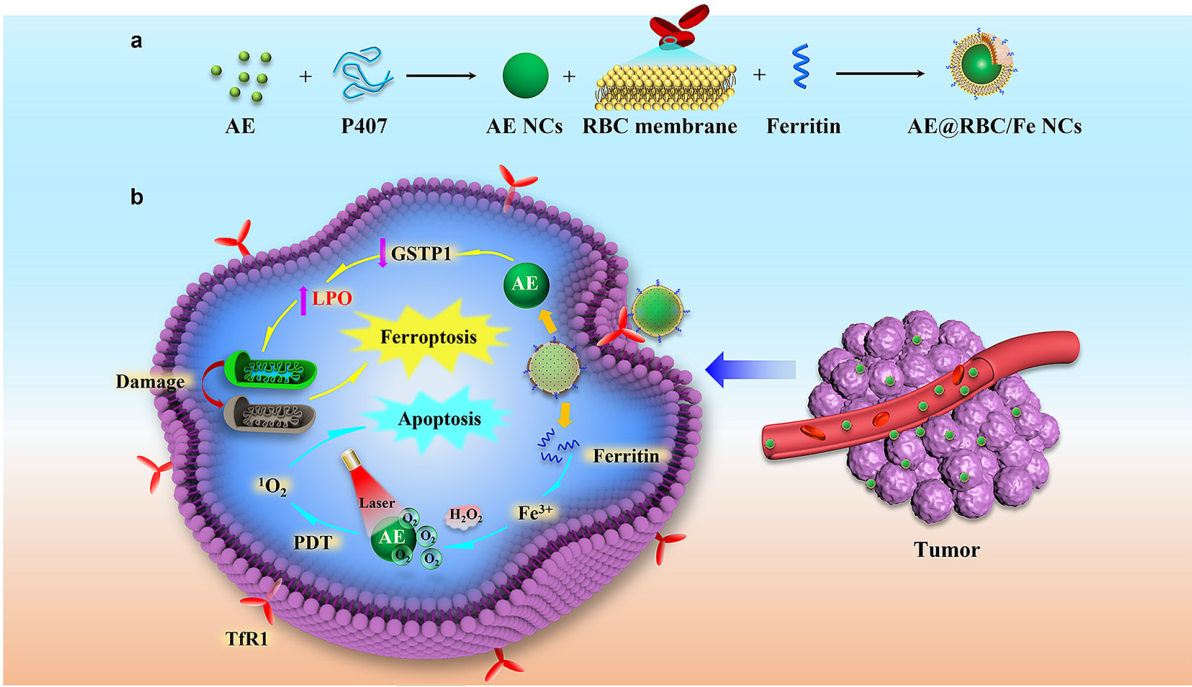
图1 AE@RBC/Fe NCs的构建及抗肿瘤机制
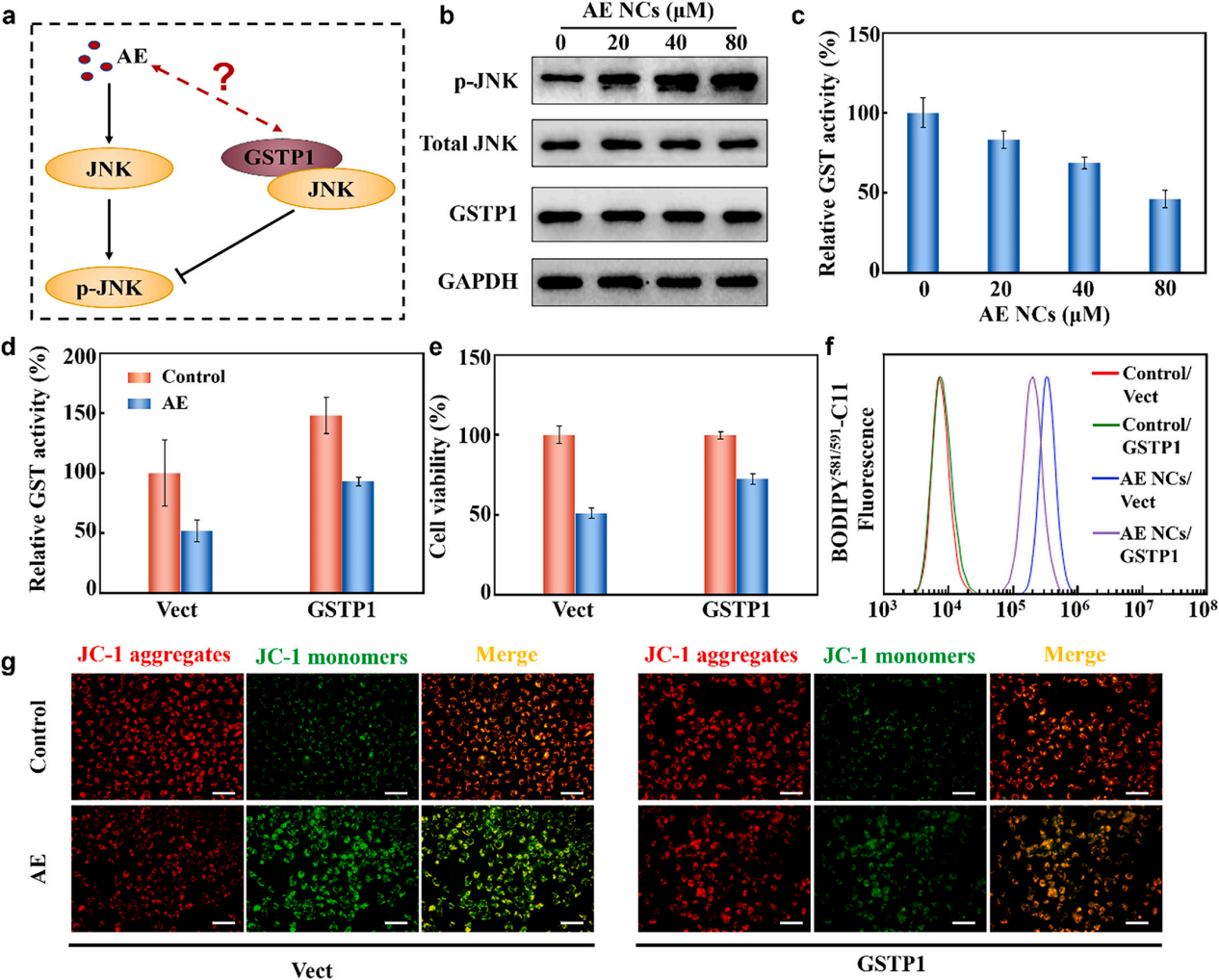
图2 AE激活铁死亡的机制研究
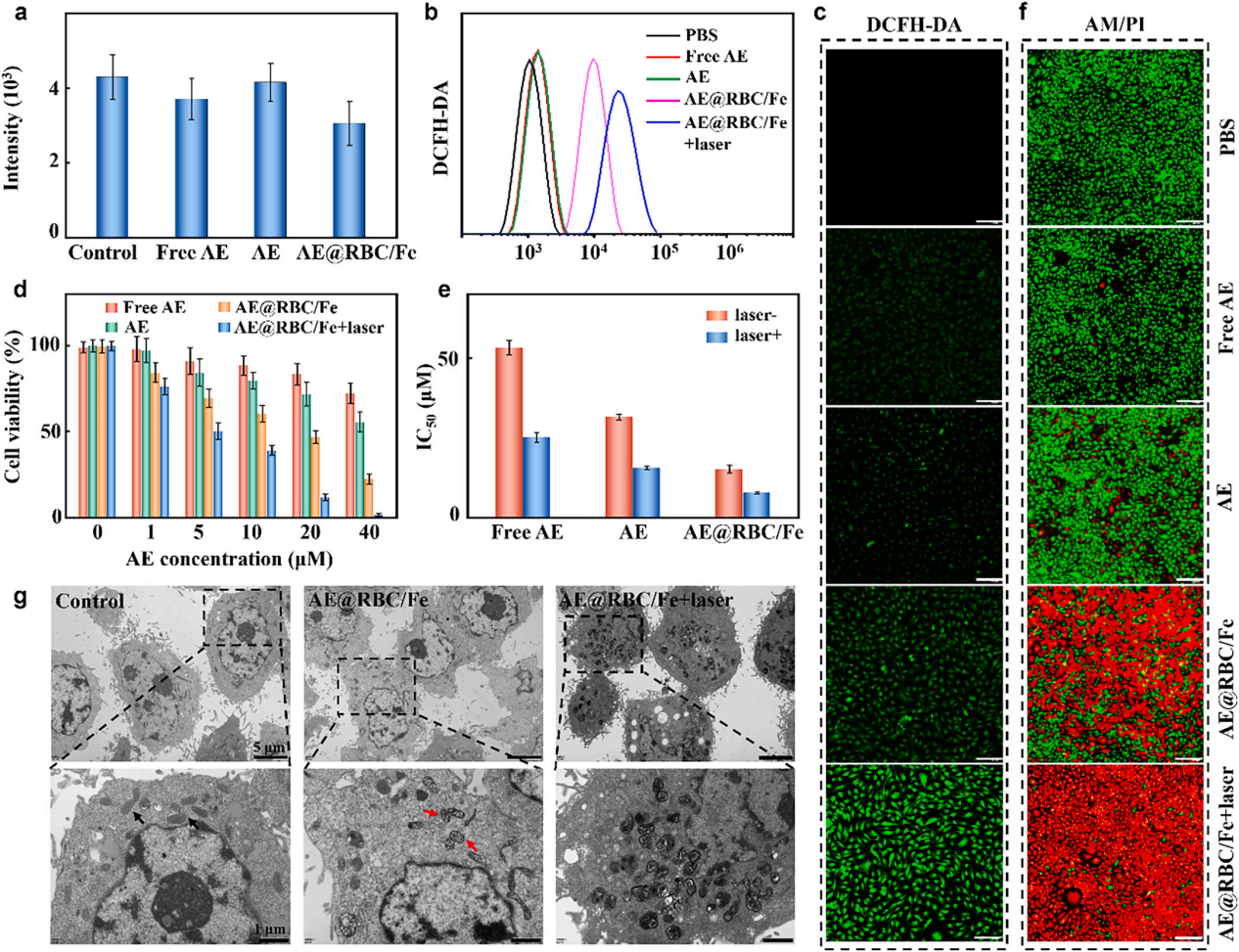
图3 AE@RBC/Fe NCs的体外抗肿瘤效果
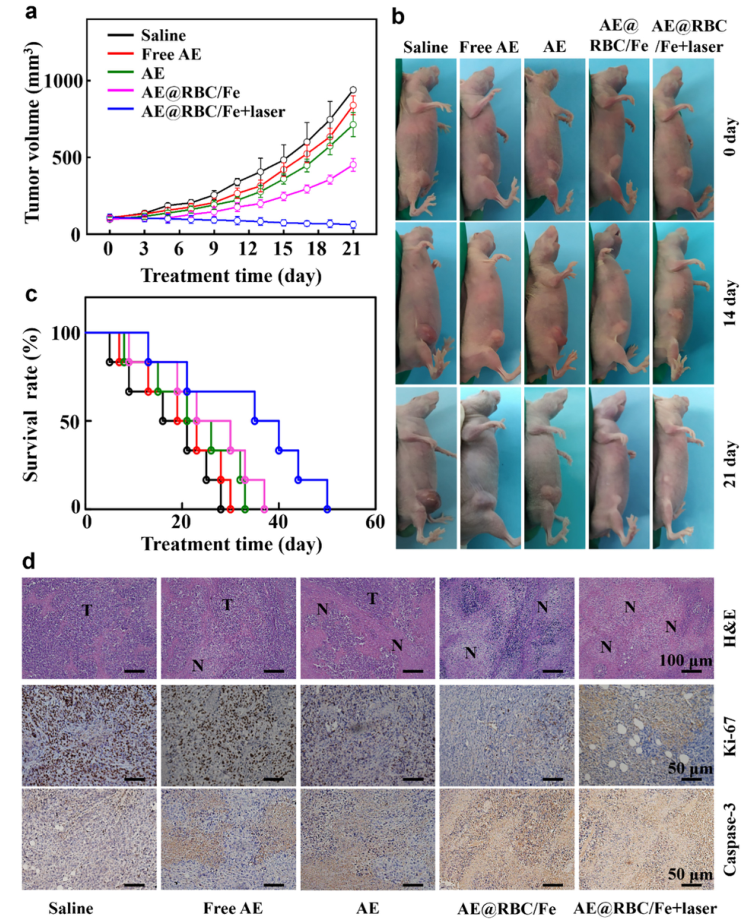
图4 AE@RBC/Fe NCs的体内抗肿瘤效果
该工作以“Biomimetic photosensitizer nanocrystals trigger enhanced ferroptosis for improving cancer treatment”为题发表在国际权威期刊《Journal of Controlled Release》上。四川大学华西医院吴明波和凌文武为论文的共同第一作者,成都医学院赵龙和赵冶为共同通讯作者。
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0168365922007714?via%3Dihub
DOI:10.1016/j.jconrel.2022.11.026
下载:Biomimetic photosensitizer nanocrystals trigger enhanced ferroptosis for improving cancer treatment
- 烟台大学/潍坊中医药产研院陈大全教授团队 JCR: 仿生活性氧/氮纳米清除剂抑制“铁死亡风暴”调节免疫靶向急性肾损伤 2025-01-10
- 南方医大沈折玉教授 Biomaterials: 中空介孔三氧化二铁纳米药物介导的瘤内Fe3+/2+循环催化用于大肿瘤铁死亡治疗 2024-11-01
- 南华大学喻翠云/魏华/张海涛团队 JNB:调控组氨酸磷酸酶-铁死亡串扰 - 用于肝细胞癌高效治疗及其机制的研究 2024-10-18
- 香港中文大学(深圳)唐本忠院士团队 ACS Nano:基于AIEgen的可见光穿透器用于深层组织感染的光动力治疗 2024-10-21
- 吉大杨英威教授、王林教授《Nano Lett.》:新型柱芳烃基共价有机骨架材料助力精准清除牙周致病菌 →放大光动力治疗效果 2024-10-21
- 仰大勇/刘培峰/姚池合作 AM:DNA纳米复合物用于基因编辑系统和光动力治疗试剂可控共递送 2024-01-19
- 中山大学吴丁财/黄榕康/郑冰娜/王辉团队 Adv. Mater.:具有长驻留性的可注射多孔炭纳米酶水凝胶实现肿瘤的协同治疗 2025-07-04
