目前,通过化学疗法治疗癌症患者是临床研究热点之一,但是由于抗癌药物的副作用和多次药物后的免疫力现象导致化学疗法在临床医学上受到极大限制。由于肿瘤细胞扩散较快,单纯的基因治疗难以达到长期抑制的作用。因此联合基因和药物控释治疗方法,抑制肿瘤细胞并避免多次服用药物引起的药物免疫性,目前已成为新的研究方向。这种方法对载体材料提出了较高要求,需要同时负载抗癌药物和目标基因并且互不干扰,有效地将药物和基因输送到靶细胞并进行释放和表达。
这项工作通过点击化学反应和酰胺化反应,合成以壳聚糖 (Cs) 为主链、聚酰胺-胺树枝状分子 (polyamidoamine, PAMAM) 基元和脱氧胆酸 (DCA) 为侧链的两亲性梳形聚合物 (PAMAM-Cs-DCA) (Scheme 1)。1H NMR和FTIR表征确定了产物的结构 (Figure 1)。
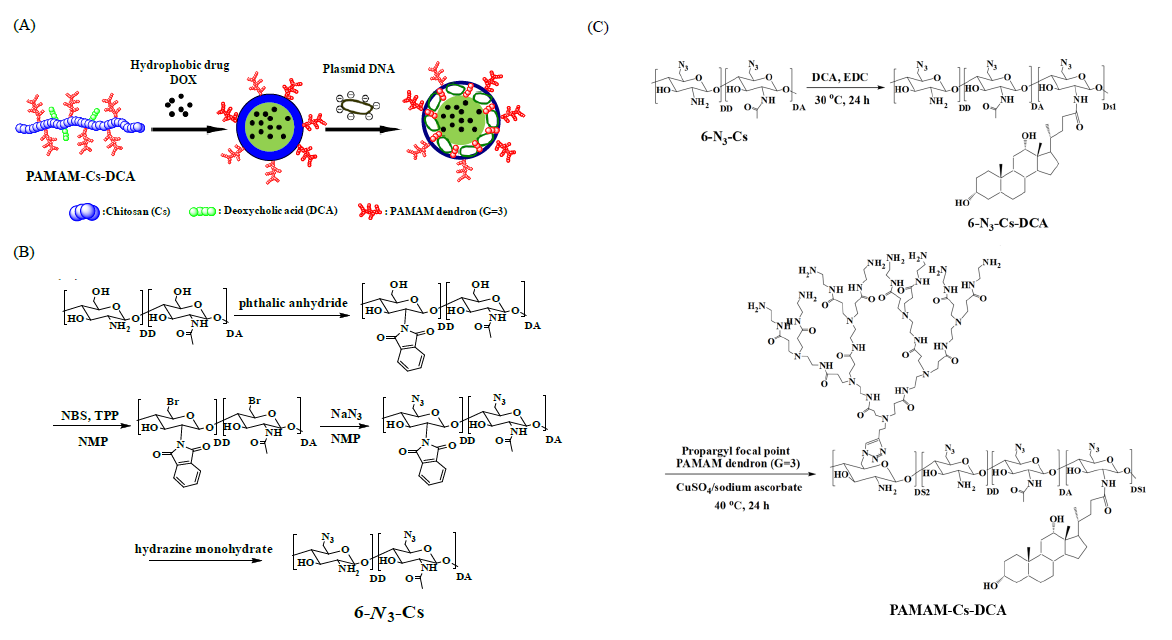
Scheme 1. (A) Schematic representation of co-delivering hydrophobic drug and pDNA by PAMAM-Cs-DCA. Synthesis routes of (B) 6-N3-Cs and (C) PAMAM-Cs-DCA.

Figure 1. (a) FT-IR spectra of propargyl focal point PAMAM dendron (G=3), 6-N3-Cs-DCA and PAMAM-Cs-DCA. (b) 1H NMR spectra of PAMAM dendron (G=3), 6-N3-Cs-DCA7, and PAMAM14-Cs-DCA7 in DMSO-d6.
PAMAM-Cs-DCA在水中自组装形成以PAMAM和Cs为亲水外壳、DCA为疏水内核的纳米胶束,通过荧光光谱、动态光散射(DLS)和TEM测试,研究了PAMAM-Cs-DCA的胶束化行为 (Figure 2)。
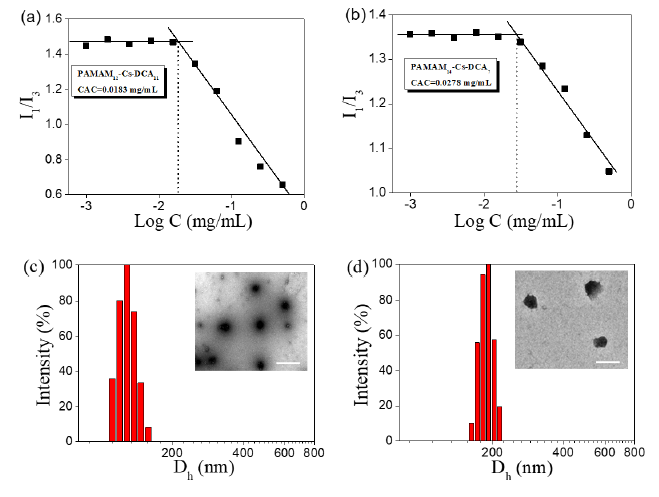
Figure 2. Intensity ratios (I1/I3) from pyrene emission spectra in PBS buffer (pH 7.4) against the logarithm of concentration of (a) PAMAM12-Cs-DCA11 NPs or (b) PAMAM14-Cs-DCA7. TEM images and size distributions obtained from DLS of the NPs from (c) ) PAMAM12-Cs-DCA11 and (d) PAMAM12-Cs-DCA11-DOX.
以阿霉素为模型药物,考察了PAMAM-Cs-DCA纳米胶束的药物负载能力和药物释放行为,药物负载率随着DCA取代度的增加而增加,在整个药物释放过程中载药胶束PAMAM-Cs-DCA-DOX的药物释放速率都保持缓慢而稳定,并随着pH值的降低而变快 (Figure 3)。

Figure 3. In vitro release profiles of entrapped DOX from PAMAM12-Cs-DCA11 NPs and PAMAM14-Cs-DCA7 NPs in phosphate buffer (pH 7.4 or 5.2) at 37 ℃. The inset is an enlarged image for showing the initial release. (n=3, mean ± standard deviation)
凝胶电泳实验表明当N/P值大于等于1:1时,PAMAM-Cs-DCA和负载药物的PAMAM-Cs-DCA-DOX都能通过亲水壳PAMAM基元包裹pDNA,并完全阻滞pDNA在凝胶电泳中的迁移。DLS和Zeta电位测试表明,PAMAM-Cs-DCA和PAMAM-Cs-DCA-DOX能和pDNA形成粒径为200-300 nm的球形复合物,表面电荷为正值。MTT测试表明PAMAM-Cs-DCA和PAMAM-Cs-DCA-DOX在293T细胞中具有较低的细胞毒性,远低于PEI(25 KDa)的细胞毒性;负载药物的PAMAM-Cs-DCA-DOX的细胞毒性稍大于PAMAM-Cs-DCA。PAMAM-Cs-DCA / pDNA复合物和PAMAM-Cs-DCA-DOX / pDNA复合物都能有效地将pDNA转进293T细胞中,转染效率随N/P值的增加而增加;并且负载阿霉素后,复合物的转染效率稍微降低 (Figure 4和Figure 5)。

Figure 4. Transfection efficiency of PAMAM12-Cs-DCA11 NPs/pDNA, PAMAM14-Cs-DCA7 NPs/pDNA, PAMAM12-Cs-DCA11-DOX NPs/pDNA and PAMAM14-Cs-DCA7 -DOX NPs/pDNA complexes in 293T cells at various N/P ratios using PEI/DNA complexes as the control. (*p<0.05, n=3, mean ± standard deviation)
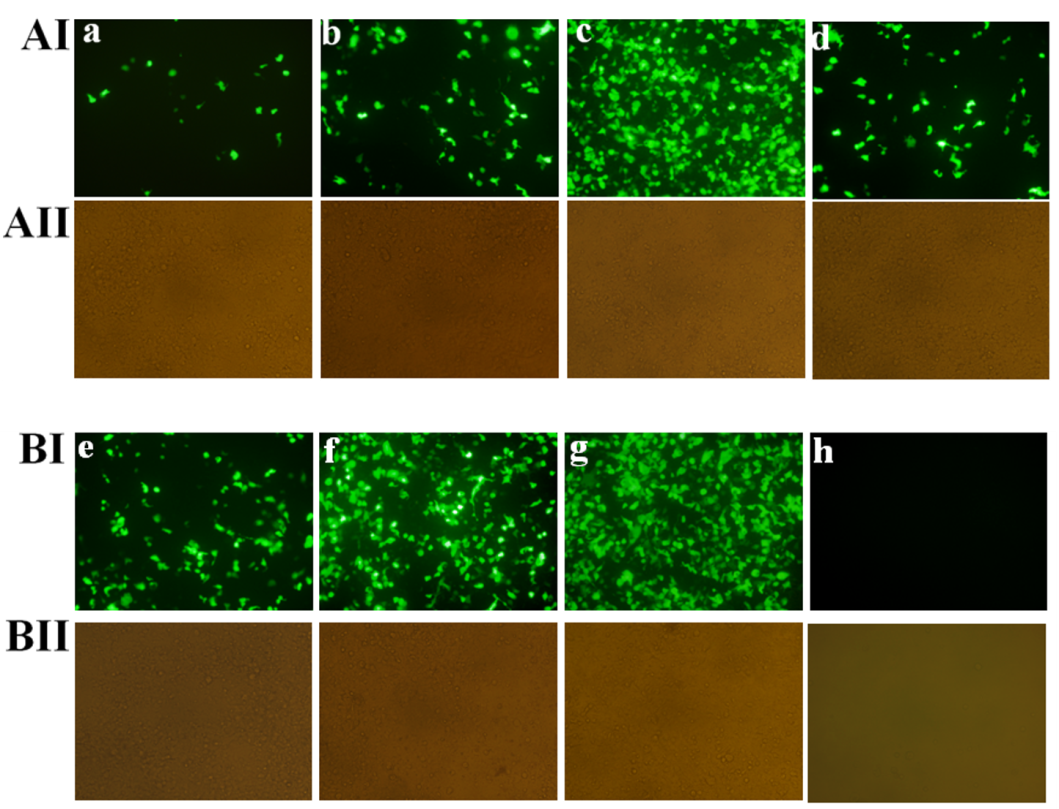
Figure 5. Representative fluorescence images of 293T cells transfected by PAMAM12-Cs-DCA11NPs/pDNA complex (a: N/P 5:1; b: N/P 10:1; c: N/P 20:1), PAMAM12-Cs-DCA11-DOX NPs/pDNA complex (d: N/P 5:1; e: N/P 10:1; f: N/P 20:1), PEI/pDNA complex (g: N/P 10) and native pDNA (h) (AI and BI: fluorescence field images; AII and BII: bright field images).
以上相关成果以“Cationic nanoparticles self-assembled from amphiphilic chitosan derivatives containing poly(amidoamine) dendrons and deoxycholic acid as a vector for co-delivery of doxorubicin and gene”为题在 Carbohydrate Polymers (2021,Article 117706) [SCI impact factor: 7.182] 上发表。论文的共同第一作者为陈珊珊博士生和邓俊杰博士,通讯作者为中山大学材料科学与工程学院张黎明教授。该研究得到国家自然科学基金、广东省自然科学基金和聚合物复合材料及功能材料教育部重点实验室的资助与支持。
论文链接: https://www.sciencedirect.com/science/article/abs/pii/S014486172100093X
- 江南大学付少海/王冬团队 Small:原位矿化生成的双网络结构壳聚糖复合气凝胶用于替代石油基保温材料 2025-10-27
- 暨大刘明贤教授团队 Bioact. Mater.: 纳米粘土增强的3D打印壳聚糖水凝胶用于止血与感染伤口修复 2025-08-28
- 新疆大学吐尔逊·阿不都热依木教授团队 J. Hazard. Mater./CEJ:壳聚糖基分子印迹电化学传感器的构筑及其性能研究 2025-08-06
- 北化大徐福建教授和山东肿瘤医院杨明教授:基于乳糖构建支化阳离子基因载体递送CRISPR/Cas9基因编辑系统用于原位肝癌的治疗 2020-07-24
- 北京化工大学徐福建教授团队:基于开环反应构建新型还原响应型支化聚赖氨酸基因载体 2019-03-21
- 暨南大学薛巍教授课题组在《Small》发表肿瘤靶向基因治疗的首例蠕虫状仿生基因载体系统研究成果 2018-11-26
