光动力疗法具有创伤小、适用性好、毒副作用低等特点,在疾病治疗尤其是癌症治疗领域有着广阔的应用前景。光敏剂在特定波长的光辐照下,敏化氧气产生具有生物毒性的活性氧物种,能够杀灭癌细胞。然而,在接受光动力学治疗后,体内残留的光敏剂往往需要较长时间才能完全代谢。残留的光敏剂一旦暴露在光照下仍会表现出光毒性,从而对组织造成不同程度的损伤。如何在实施光动力学治疗后使光敏剂及时失效,从而避免光敏剂残留带来的安全性问题,一直是光动力学疗法需要解决的问题之一。
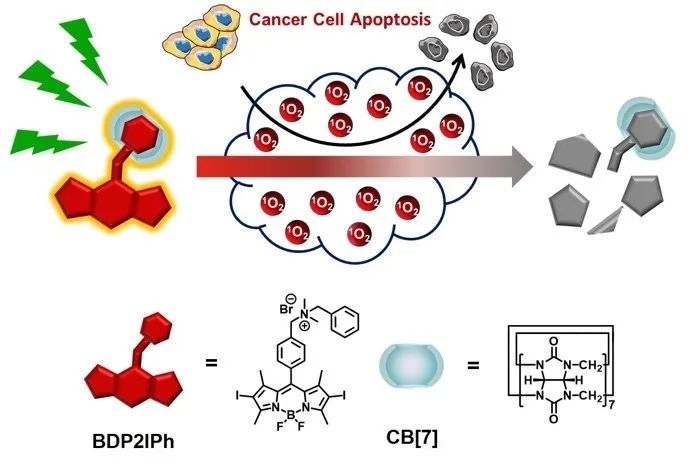
近日,清华大学张希教授、徐江飞副研究员及其团队利用超分子策略调节光敏剂的活性,构筑了具有自降解性质的超分子光敏剂,为实现高效安全的光动力学治疗提供了新策略。他们通过主客体相互作用调节光敏剂的光物理和光化学性质,在提升光敏剂敏化氧气产生活性氧物种效率的同时,也加速了光敏剂自身的氧化降解速率。在实施光动力学治疗时,超分子光敏剂敏化产生的活性氧物种快速累积并引发细胞凋亡,同时光敏剂自身被氧化而不断消耗,治疗完成后光敏剂完全降解为不具有光活性的低毒物质。
研究人员通过阳离子型氟硼吡咯光敏剂(BDP2IPh)与大环分子葫芦[7]脲(CB[7])的主客体组装,构筑了超分子光敏剂BDP2IPh-CB[7]。研究表明,超分子光敏剂具有更长的三线态寿命,因而提升了其敏化氧气产生活性氧物种的效率;同时,CB[7]的引入降低了光敏剂分子的氧化还原电位,使其更容易被氧化,加速了光照下光敏剂分子的氧化降解速率;此外,CB[7]能够有效屏蔽光敏剂分子的正电荷和疏水端,从而降低了光敏剂的暗毒性。细胞实验表明,超分子光敏剂对细胞的暗毒性显著降低,而光照下的光动力学治疗效果则保持高效;更重要的是,当光动力学治疗完成后,超分子光敏剂被及时降解,即使再次光照也不再表现出细胞毒性,从而避免了光敏剂残留可能引起的副作用。
这一策略有望用于其它类型的商用或合成光敏剂,进而构筑一类高效低毒无残留的超分子光敏剂,为解决光敏剂残留的安全性问题、实现高效安全的光动力学治疗提供新的策略。相关工作发表在Angew. Chem. Int. Ed.并被选为VIP文章。
论文链接:https://doi.org/10.1002/anie.202012477
- 中国科大刘世勇教授团队 Angew:基于精准高分子化学的单组分极紫外光刻胶 2024-09-29
- 澳门大学代云路课题组《Adv. Sci.》:自降解纳米凝胶通过药物再利用策略重塑肿瘤微环境以重新激活CD8? T细胞 2023-05-11
- 天津大学仰大勇团队 Adv. Mater.:储能DNA纳米复合物实现无激发光源的光动力学治疗 2022-01-27
- 浙江大学计剑、金桥课题组《ACS Nano》:通过抑制呼吸作用改善乏氧和诱导促死亡自噬提高光动力学治疗效果 2020-08-04
- 中国科学技术大学王育才教授与徐航勋教授在氧化石墨炔光催化产氧及其在光动力学治疗应用研究中取得新进展 2019-06-25
