阿尔茨海默病(Alzheimer''s disease,AD)是一种常见的中枢神经系统退行性疾病,对社会和家庭造成很大危害。目前许多多肽,核酸等生物大分子药物在AD的临床前研究中展示出巨大潜力,却止步于三期临床试验。其原因主要有:一方面,生物大分子药物在体内的不稳定性影响了其在临床使用时的有效性和安全性;另一方面,复杂的脑环境导致药物静脉注射后难以到达脑部AD病变部位,大大限制了其治疗效果。因此,设计开发既能充分入脑,又能选择性到达AD病变部位的大分子药物,是当下的临床难点和研究热点。通过设计高效靶向AD病变部位的递药系统,有望突破以上难题。
四川大学高会乐教授课题组前期设计了可主动识别血脑屏障转铁蛋白受体并在溶酶体内脱离,从而促进跨膜转运的纳米载体用于脑肿瘤靶向治疗(Adv Funct Mater, 2018, 28, 1802227)。在此基础上,该研究设计了一种以树枝状聚赖氨酸(Dendrigraft poly-l-lysine,DGL)为载体的纳米粒,其表面通过酸响应裂解的长链聚乙二醇(Polyethylene glycol,PEG)修饰T7多肽,并通过短链PEG修饰Tet1多肽,用于AD治疗多肽药物和siRNA的多级靶向递送。该纳米粒表面的T7可与BBB高表达的转铁蛋白受体结合而促进内皮细胞摄取,并在溶酶体内快速响应偏酸微环境而断裂,使得纳米粒迅速脱离T7与转铁蛋白受体的复合物而顺利逃逸溶酶体,促进药物跨细胞转运,从而有效提高药物入脑效率。长链PEG断裂后暴露出的Tet1,可进一步引导药物靶向神经元,提高药物对AD病变区的选择性。同时,该功能纳米粒可将抑制Aβ产生的siRNA和抑制tau蛋白过度磷酸化(p-tau)的Dp肽联合递送至神经元细胞内,协同改善AD造成的认知功能障碍和神经元损伤。
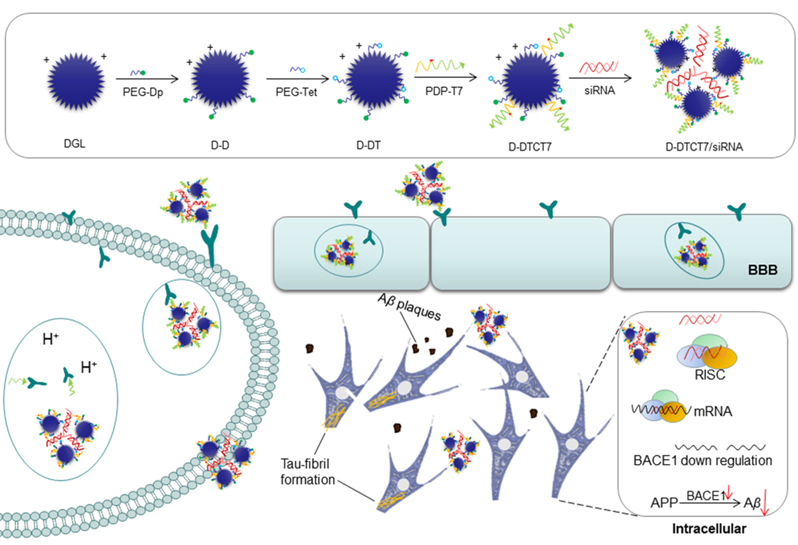
图1:多级靶向纳米粒促进药物跨BBB和靶向神经元,同时递送两种药物联合治疗AD的方案示意图。
该设计主要解决了目前纳米递药系统对AD治疗的几个关键问题:一是在保持较高的BBB特异性靶向及内吞效率的同时,进一步提高纳米粒与脑毛细血管内皮细胞膜蛋白分离、逃离溶酶体的能力;二是提高靶向脑部神经元的能力,从而增加纳米粒在AD病灶部位的浓度;三是实现了两个病理靶点Aβ和p-tau的同时抑制,协同提高了AD的治疗效果。本文为设计脑部靶向药物和AD联合治疗方案提供了新思路。
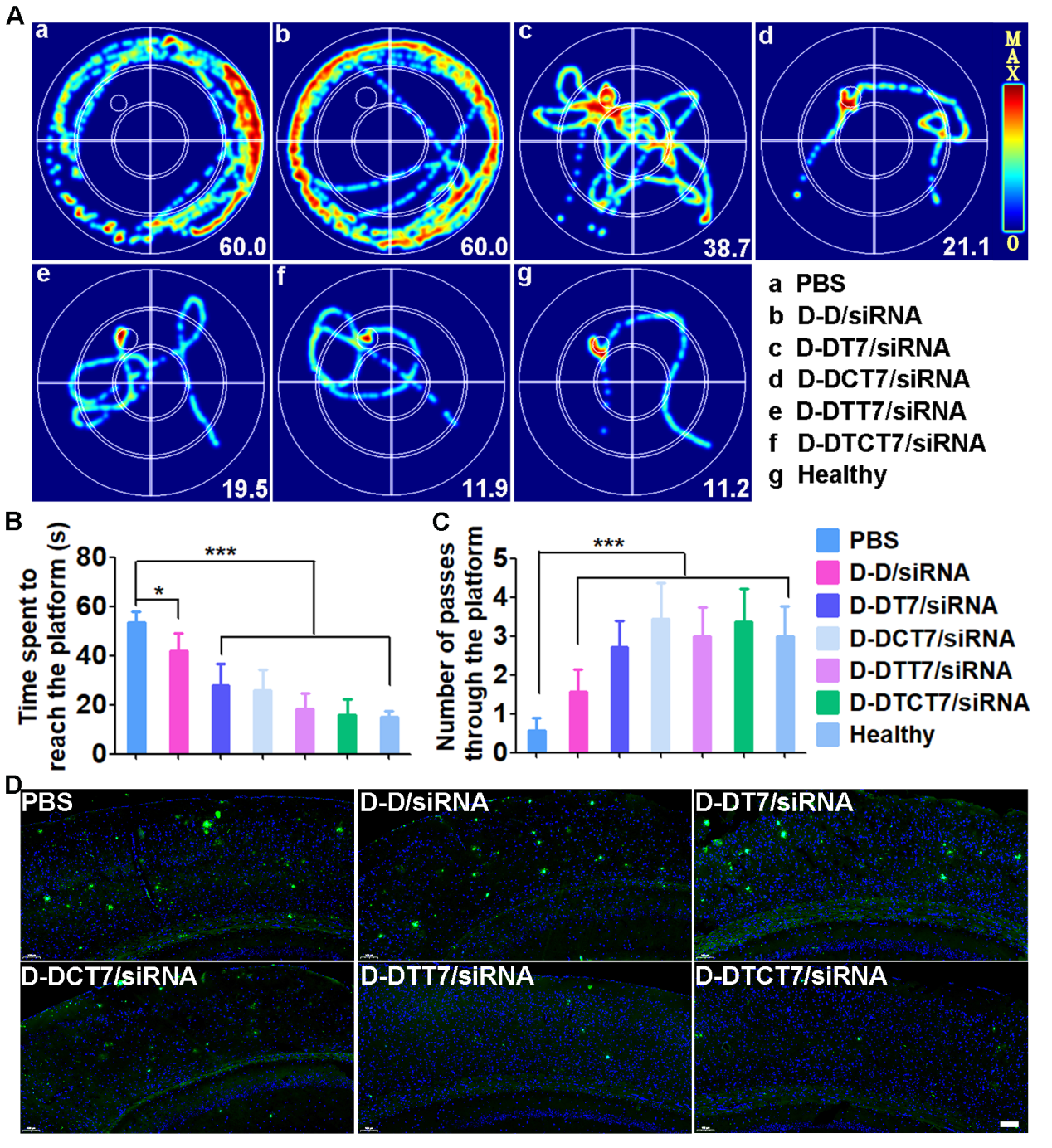
图2 多级靶向纳米粒改善模型小鼠学习认知和减少脑内Aβ斑块。
相关研究工作以“Endo/lysosome-escapable Delivery Depot for Improving BBB Transcytosis and Neuron Targeted Therapy of Alzheimer''s Disease”为题,发表在Advanced Functional Materials上(DOI: 10.1002/adfm.201909999,IF=15.621)。第一作者为电子科技大学蔡璐璐副教授和杨钏瑶硕士,通讯作者为四川大学高会乐教授和电子科技大学童荣生教授。
论文链接:https://doi.org/10.1002/adfm.201909999
作者简介:
蔡璐璐,药学博士,电子科技大学附属医院(四川省人民医院),副教授,硕士研究生导师。先后在日本和美国访问学习,并曾在四川大学生物治疗国家重点实验室硕博连读和从事博士后工作。入选四川省学术技术带头人后备人选,四川省高层次海外留学人才。任中国医药生物技术协会纳米技术分会委员、四川省国际医学交流促进会生物免疫治疗专委会委员等。研究方向为病灶靶向的微纳药物制剂。
- 兰州大学唐瑜、吕少瑜 Adv. Mater.:有机亚稳室温磷光水凝胶 2026-02-21
- 兰州大学范增杰团队 Adv. Mater.:3D打印动态适应性梯度压电支架用于肌腱高效再生修复 2026-02-15
- 东华大学武培怡/雷周玥团队《Adv. Mater.》: 具有宽带粘弹性平台的离子液体凝胶用于非侵入型高保真神经界面 2026-02-14
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
