在骨科/口腔植入物领域,感染与骨整合不良始终是两大难题。如何兼顾抗菌性与成骨性,并实现涂层的稳定与通用,成为困扰该领域多年的“卡脖子”基础科学问题。近期,北京化工大学徐福建教授、段顺教授课题组联合首都医科大学附属北京口腔医院孙玉洁副主任医师团队,提出了一种仿生的“胺介导的多酚自聚涂层”策略,相关成果发表在Journal of the American Chemical Society上。该论文第一作者为北京化工大学博士研究生孙美州(石河子大学定向培养师资博士研究生),首都医科大学附属北京口腔医院博士生徐驰、北京化工大学博士研究生吴若楠、硕士研究生柯仪烟对于本研究亦有重要贡献,北京化工大学丁小康教授、赵娜娜教授、首都医科大学附属北京口腔医院耿威主任医师也对本论文提供了帮助。该研究受到国家自然科学基金重大项目的支持。
胺诱导多酚自组装负电荷涂层选择性地靶向细菌并增强骨科植入物中的骨整合示意图
该研究设计了一种基于单宁酸和胺类小分子的一步共价自聚策略,可在钛等金属植入物表面快速生成稳定的多酚涂层。与传统多步骤、多刺激响应的复杂方法相比,这种涂层制备方式更为简便、通用、稳定。涂层表面带有稳定的负电荷,不仅能选择性杀灭细菌,更能避免杀伤哺乳动物细胞(图1)。
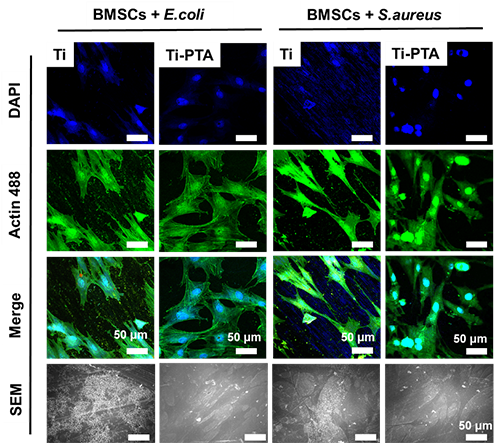
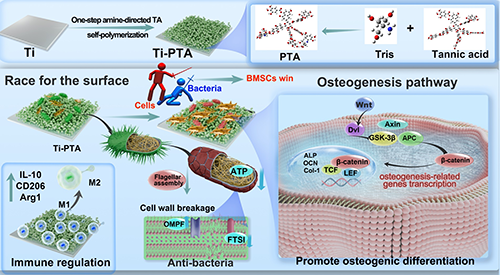
图1 Ti和Ti-PTA表面的细菌-细胞竞争性研究
研究结果表明,涂层对大肠杆菌和金黄色葡萄球菌等常见致病菌具有明显抑制作用,且杀菌效果依赖于接触而非渗出,避免了传统抗菌剂释放后失效和毒性的风险。多组学机制研究表明,多酚涂层可抑制细菌趋化相关蛋白表达,阻断FTSI等细胞壁蛋白合成,干扰质子泵与电子传递链功能,最终导致细菌膜结构崩解,失去活性(图2)。值得注意的是,哺乳动物细胞对该涂层表现出良好的生物相容性。在成骨方面,该涂层显著促进骨髓间充质干细胞的黏附、增殖与分化。基因转录组分析显示,其上调了Runx2、Col-1、OCN等关键成骨基因的表达,并通过激活Wnt/β-catenin信号通路实现机制调控(图3)。
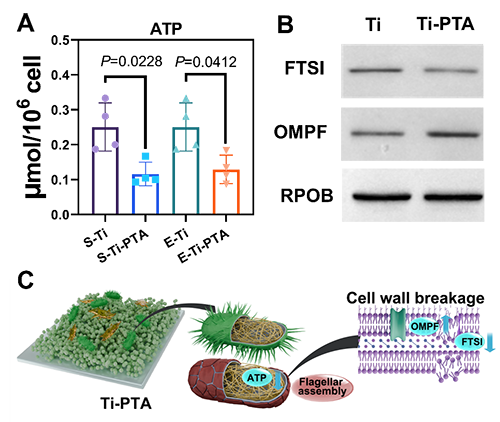
图2 A)Ti和Ti-PTA处理E.coli后的ATP含量变化。B)OMPF和FTSI的相对蛋白表达。C)Ti和Ti-PTA处理E.coli的抗菌机制图。

图3 A)在Ti和Ti-PTA表面上培养的BMSCs的成骨相关蛋白表达的Weston blot图像;B)Ti-PTA表面促进成骨作用的机制示意图。
在感染动物模型中,Ti-PTA涂层组实现了51.9%的骨整合提升率,远高于未处理组,且组织炎症反应显著减少,表现出优异的促骨整合/抗炎协同效应(图4)。
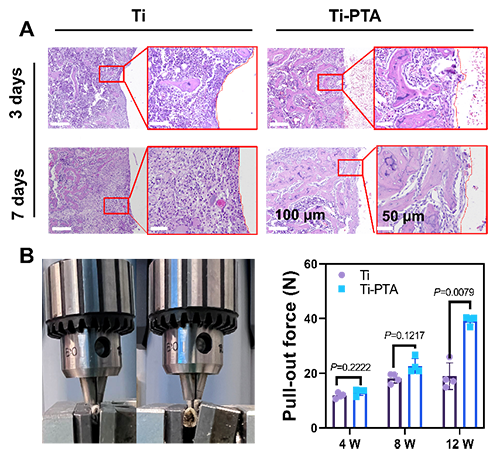
图4 A)Ti和Ti-PTA种植体周围H&E染色图片;B)Ti和Ti-PTA种植体在4 w, 8 w和12 w的力学拔出性能测试。
该策略不仅适用于钛金属表面,还在不锈钢、PEEK、PMMA、聚氨酯、硅橡胶等7种常见医疗材料中表现出良好的适配性(图5),其特点包括不依赖释放,具备长期稳定性;接触杀菌机制,生物安全性好;方法便捷,便于规模放大等,具有广泛的推广前景。
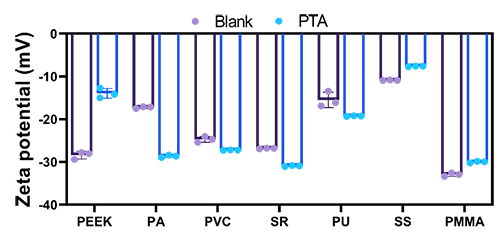
图5 PTA涂层的普适性验证
总而言之,该研究提供了一种兼顾选择性抗菌和成骨诱导的植入体表面化学结构调控策略,为骨科与口腔植入物的表面工程提供了新思路。
文章链接:https://pubs.acs.org/doi/10.1021/jacs.5c07074?fig=fig6&ref=pdf
- 四川大学梁坤能、邓怡 ACS Nano:用于感染性骨缺损快速杀菌与骨整合的非氧依赖型硫酸根自由基和Fe2+修饰植入物 2025-05-16
- 四川大学邓怡、梁坤能 Adv. Mater.:构筑用于感染性组织再生的生物异质结及其通过激活类感受态抗菌策略快速杀菌 2024-10-22
- 武汉理工大学戴红莲教授课题组 AFM:诱捕细菌联合磁热协同杀菌的智能给药系统高效修复感染性骨缺损 2023-04-02
- 北化徐福建/段顺、北京口腔医院孙玉洁团队 Adv. Mater.:种植体表面化学结构调控细胞-细菌竞争性行为 2025-07-04
- 北化张好斌教授《ACS Nano》:基于化学结构调控策略实现氧化石墨烯自发规整组装 2022-05-27
