颠覆认知:维生素C的“双面人生”
你以为维生素C(VC)只是美白防感冒的“养生小能手”?中国科学技术大学李敏/王育才团队最新研究发现,高剂量VC竟是潜伏在肿瘤细胞内部的“特洛伊木马”——它通过伪装成营养分子潜入肿瘤老巢,从内部引爆“氧化炸弹”,联手免疫系统对肿瘤细胞发起致命围剿!这项发表于ACS Nano的研究,为肿瘤治疗带来安全、低成本的“膳食级”解决方案。
研究团队发现,肿瘤细胞高表达的SVCT2转运受体使VC选择性富集于病灶区域,在近红外II区光热(NIR-II PTT)引发的局部高温下,VC通过级联反应放大氧化应激,使肿瘤细胞对热疗的敏感性显著提升。与此同时,两者联合激活的NF-κB信号通路驱动趋化因子CXCL16高表达,形成“免疫细胞导航信号”,吸引CXCR6+ T细胞浸润至肿瘤部位,发挥肿瘤杀伤作用。临床队列分析显示,肿瘤组织CXCL16和CXCR6的高表达与患者生存率及免疫细胞富集呈正相关,提示该研究与实际临床的一致性(图1)。
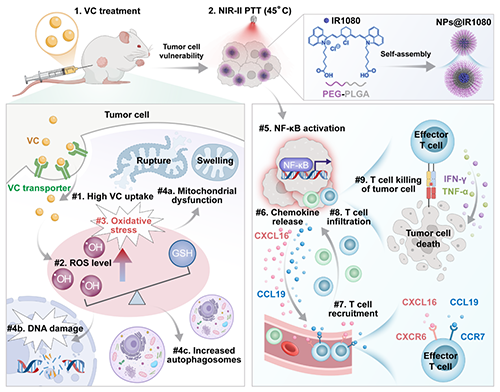
图1. 高剂量VC和NIR-II PTT的协同抗肿瘤作用。
首先,研究团队发现高剂量VC与NIR-II PTT的联合治疗产生了远超预期的抗肿瘤效果,且可达到“1+1>2”的协同增效作用。进一步研究发现,VC存在明显的剂量阈值效应,当VC剂量达到或超过1.5 g/kg时即可显著增强光热疗效;随着VC剂量增加,肿瘤组织中ROS水平呈明显的剂量依赖性升高,提示了VC诱导的ROS产生对于其増敏光热的重要性(图2)。
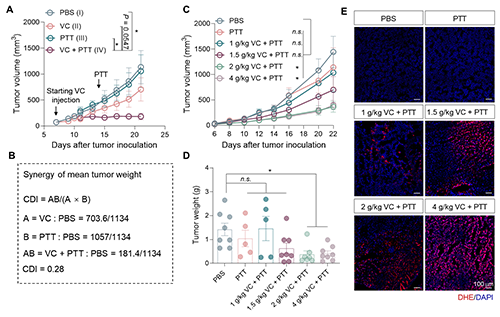
图2. 高剂量VC增强NIR-II PTT抗肿瘤效应。
为了进一步揭示VC如何增强NIR-II PTT效果,研究团队比较了肿瘤细胞和非肿瘤细胞在不同浓度VC处理后的存活情况。结果表明,VC能显著降低结肠癌细胞CT26的活力,而对非肿瘤细胞NIH3T3几乎无影响。且CT26细胞在VC处理后出现线粒体肿胀、损伤以及自噬体积聚等典型氧化损伤特征。在体内实验中,也观察到VC对肿瘤组织的选择性毒性效应(图3)。这一选择性主要是通过肿瘤细胞表达VC转运受体Glut1和SVCT2实现的。
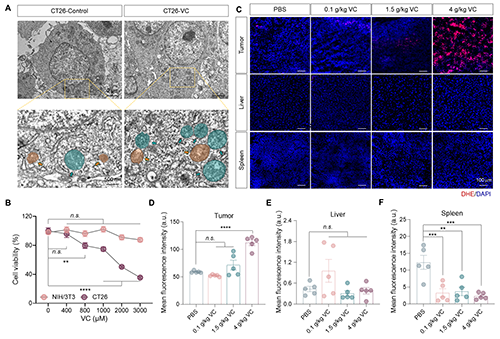
图3. 高剂量VC选择性诱导肿瘤细胞敏感性。
为了探究联合疗法是否依赖免疫系统介导,结果显示联合治疗组CD8+ T和CD4+ T细胞的肿瘤浸润显著增加,且CD8+ T细胞呈现更高比例的效应记忆(CD44+ CD62L-)和中央记忆(CD44+ CD62L+)表型;且T细胞缺陷鼠和T细胞清除鼠中联合疗法的抗肿瘤效果消失,进一步证明T细胞免疫应答在联合疗法抗肿瘤效果中的关键作用。进一步研究发现,联合治疗可高效増敏免疫检查点抑制剂疗法(图4)。
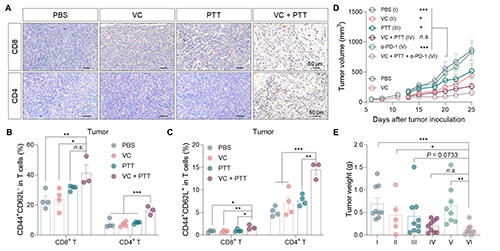
图4. 联合治疗的协同杀伤作用依赖于T细胞免疫反应。
最后,研究团队通过RNA测序分析了联合疗法治疗的早期阶段肿瘤转录组变化,结果显示联合治疗组呈现出免疫激活的特征,包括细胞因子和炎症信号通路的上调(如Il6、Il7r、Nfkb1),以及T细胞募集相关趋化因子(如Ccl19、Cxcl16)的显著升高,其可招募CXCR6+ T细胞的大量浸润,发挥抗肿瘤效应。研究团队还通过分析结肠癌患者数据库发现,肿瘤组织CXCR6表达水平与患者生存期、CD8A和CD4表达高度正相关,因此CXCR6表达可作为T细胞浸润和患者预后良好的潜在生物标志物(图5)。
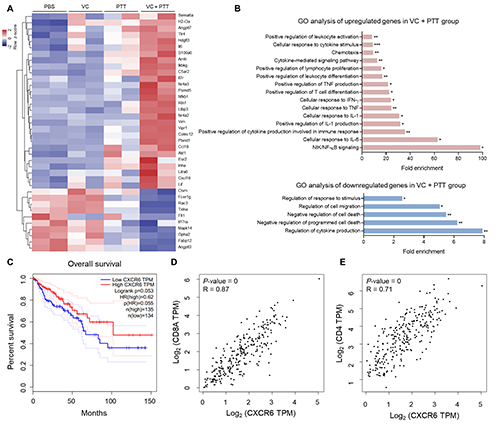
图5. 联合疗法诱导T细胞相关趋化因子表达。
相关工作以“Leveraging Vitamin C to Augment Nanoenabled Photothermal Immunotherapy”为题在ACS Nano发表。中国科学技术大学李敏副教授和王育才教授为论文的通讯作者,博士研究生邓吴娴和汪义媛为论文的第一作者。该研究工作得到了国家重点研发项目、国家自然科学基金、中国科学院战略性先导科技专项、安徽省重点研发项目、安徽省重大科技专项项目、安徽省自然科学基金项目、中国科大“双一流”项目和安徽省高校协同创新项目的资助。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.4c17080
- 兰州理工大学冉奋教授 AFM:维生素C二次掺杂导电聚合物 2025-05-07
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
