蛋白水解靶向嵌合体(PROTAC)技术是一种蛋白质阻断技术,具有诱导抗肿瘤效应的潜在优势。然而,由于在肿瘤中的分布和积累不足,其效果受到限制。一些报道指出,配体修饰(如抗体、叶酸和适配体)可实现 PROTAC 的肿瘤靶向递送。然而,这些配体-PROTAC 共轭物存在合成过程复杂、受体表达不均、肿瘤穿透力有限等问题,限制了其临床转化和抗肿瘤效果。此外,PROTAC 通常靶向降解特定蛋白质,其抗肿瘤效果有限。因此,将 PROTAC与其它抗肿瘤疗法相结合如光动力疗法,通过简单的多功能纳米平台实现 PROTAC的肿瘤特异性分布,是一个巨大的挑战和前景。
纳米药物的尺寸和形状会显著影响其体内过程,例如循环、分布、肿瘤渗透和滞留,以及细胞内化和外排等。此前,四川大学高会乐教授课题组在粒径和形状可变纳米药物方面开展了多项研究,利用纳米药物的粒径形状可调特征实现其在肿瘤的高渗透和强滞留(Adv. Funct. Mater. 2019, 1808462;Adv. Funct. Mater. 2021, 31, 2104645;Adv Funct Mater, 2021, 31, 2009765;ACS Cent Sci, 2020, 6 (2), 100-116;Acta Pharm Sin B, 2022, 12(8):3354-3366)。
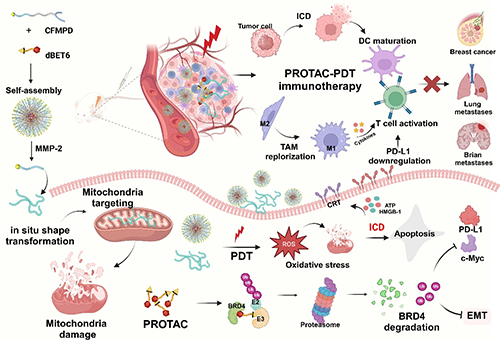
研究表明,dBET6@CFMPD呈现均一、稳定的球形,达到肿瘤部位后,由于其小尺寸,能够分布、渗透到肿瘤深部,并响应于微环境中高水平的MMP-2,由球形颗粒转变为纳米纤维,并释放PROTAC药物。这一特性能够提高PROTAC的分布和蓄积,并增强光敏剂在瘤内的渗透和滞留,提高PDT效益,促进肿瘤细胞的免疫原性死亡,激发抗肿瘤免疫。此外,纳米纤维能够进一步靶向线粒体,促进肿瘤细胞线粒体损伤,进一步促进肿瘤细胞的死亡。释放的dBET6能够降解肿瘤细胞的BRD4,下调c-Myc和上皮间质转化(EMT),促进肿瘤细胞的凋亡并抑制其迁移与侵袭。同时,dBET6能够下调PDT过程中上调的PD-L1以及调节T细胞的浸润,促进肿瘤相关巨噬细胞复极化为抗肿瘤的M1型,改善肿瘤免疫抑制微环境,进一步增强抗肿瘤效果。通过提高PROTAC-PDT效益和重塑免疫抑制微环境,dBET6@CFMPD能够激发宿主产生抗肿瘤免疫反应,抑制多种乳腺癌模型及其脑转移的进展。
原文链接:https://doi.org/10.1038/s41467-024-54854-2
