西安交大陈鑫教授课题组 Small:具有生理响应性光热转换和纳米催化医学能力的智能水凝胶-可综合抑制细菌和炎症、治疗感染性伤口
2024-10-15 来源:高分子科技
近年来,为了实现有效的抗菌治疗,已经开发出多种基于各种纳米粒子的化学动力学疗法和光热疗法。但单独使用化学动力学疗法的有限治疗效率以及光热疗法对细菌和周围健康组织的无差别损伤仍是其在感染性伤口治疗临床应用中面临的挑战。此外,在化学动力学疗法和光热疗法介导的抗菌过程中,内源性巨噬细胞容易在局部 ROS 和高热作用下转化为促炎型巨噬细胞(M1表型),从而促进炎症反应,导致组织再生被抑制,伤口可能会进一步恶化。因此,如何实现高效抗菌的同时避免炎症的产生,是一个有待研究并期待解决的问题。
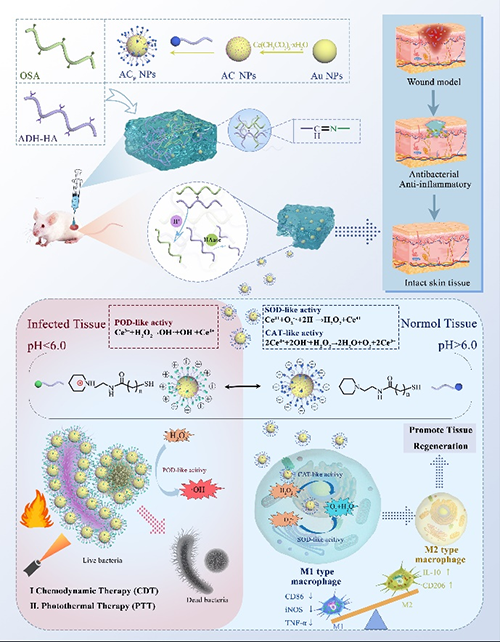
图1 复合水凝胶AO@ACP的制备示意图及其在感染伤口愈合中的应用
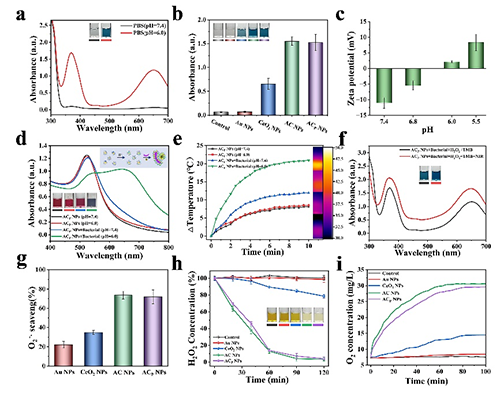
图2 体外响应性ROS产生,清除及光热性能测试
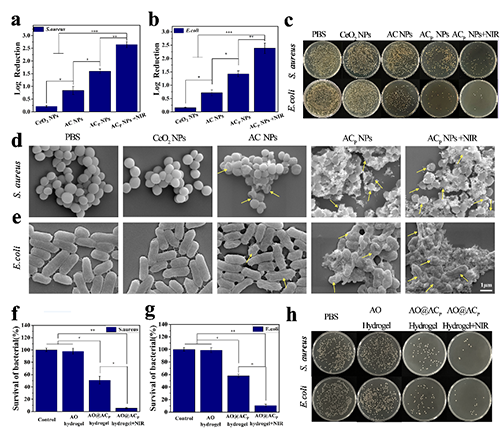
图3 体外抗菌性能表征
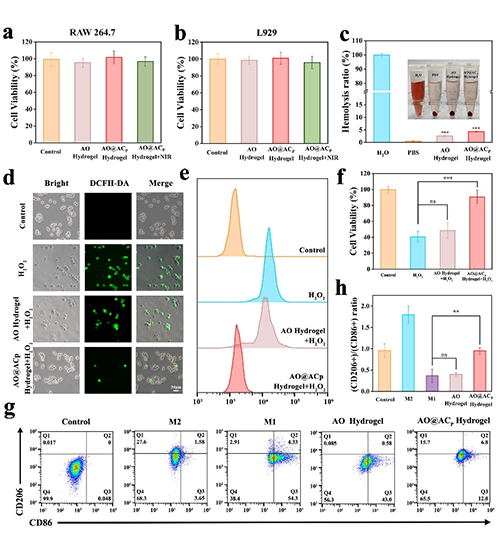
图4 体外ROS清除及巨噬细胞极化性能分析
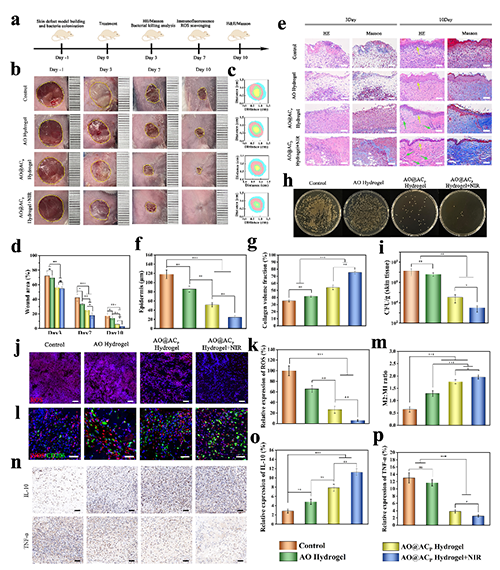
图5 体内感染伤口修复性能评价
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/smll.202405464
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 湖北大学张玉红/陈朝霞、湖北工程学院刘勇Compos. Part B:具有光热转换、抗菌、耐久性超疏水海绵用于油水分离和原油回收 2025-09-30
- 陕科大马建中/吕斌/高党鸽 Small:基于PPy/NiCoAl-LDH改性棉织物-实现储能、电磁干扰屏蔽和光热转换的有效集成 2024-11-14
- 宁波材料所陈涛/肖鹏团队 Adv. Mater. 综述:超疏水光热材料及其前沿应用 2024-05-10
- 上海东方肝胆医院杨田/杭州医学院黄东胜团队 Small Science: 纳米催化医学在肿瘤治疗领域的研究进展 2022-06-05
- 西南林大杜官本院士、杨龙研究员团队 Nano lett.:面向水下电子皮肤的温控响应纤维素基 Janus 智能水凝胶 2025-05-09
- 南开大学刘定斌教授团队 JACS:智能水凝胶精准递送外泌体 - 攻克糖尿病耐药菌感染创面愈合难题 2025-05-06
- 苏州大学王召教授团队 Nat. Commun.:二维MoS2压电催化剂加速聚合反应与水凝胶重塑 2025-02-20
