溃疡性结肠炎(UC)是一种慢性、复发性的肠道粘膜损伤,主要表现为肠粘液层耗竭、紧密连接异常和肠屏障功能障碍。肠粘液层和紧密连接是密不可分的。当二者受损时,病原菌和毒素入侵损伤肠上皮并引发炎症反馈循环,从而使UC逐渐恶化。目前,口服微生态制剂调控肠道内稳态在治疗肠道疾病方面展现出较大应用前景。然而,现有益生菌无法有效修复肠粘膜屏障并终止炎症反馈循环,使其疗效受到限制。此外,口服益生菌受到胃肠道内的恶劣环境(强酸、消化酶和氧化应激等)影响;益生菌肠道内定殖不足、无法靶向投递到肠炎部位;肠道病理环境中匮乏的营养支持等因素的限制,且益生菌消耗粘蛋白(MUC)会造成肠道损伤。这些情况严重阻碍了口服微生态制剂在肠道疾病上的应用。因此,研制新型益生菌复合体使其能够克服上述不足成为临床的迫切需要。
近期,西安交通大学第一附属医院佘军军教授/王雅助理研究员/生命学院吴道澄教授团队利用新型益生菌Akkermansia muciniphila(AKK)研发了一种胃肠道自适应和营养自供的Akkermansia muciniphila-明胶多孔微凝胶(AKK@GPMGs),并提出了通过类似“创可贴”的方法精准靶向覆盖炎症部位以修复肠粘膜屏障、打破炎症反馈循环协同治疗UC的策略(图 1)。
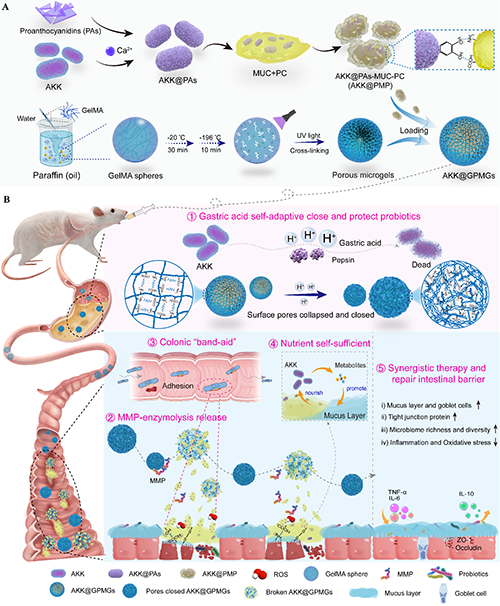
图 1. 胃肠道自适应和营养自供的Akkermansia muciniphila-明胶多孔微凝胶协同治疗溃疡性结肠炎。(A)AKK@GPMGs的制备。(B)AKK@GPMGs的性能和协同靶向治疗。
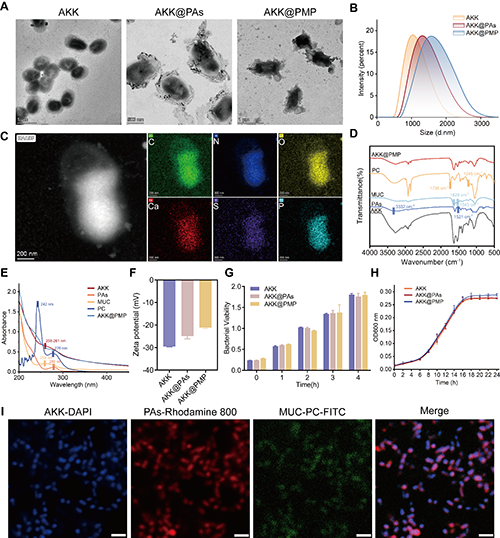

图 3. AKK@GPMGs的制备与表征。(A) 不同条件下制备的多孔微凝胶的TEM图像。多孔微凝胶的(B)粒径、(C)孔径分布和(D)形状记忆特性。多孔微凝胶经受(E)胃酸和(F)MMP 后的SEM图像。AKK@GPMGs的(G)SEM和(H)LSCM图像。
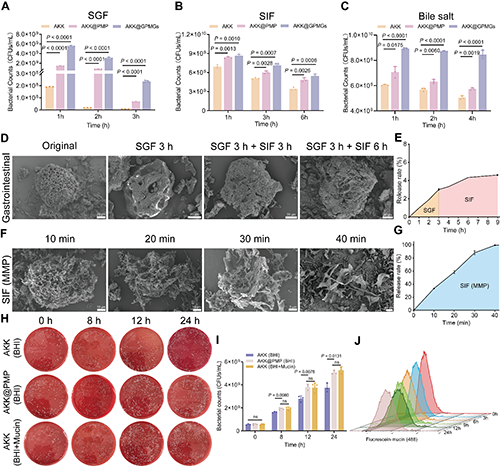
图 4. AKK@GPMGs对胃肠道环境的抵抗力、MMP响应的释放行为以及营养自供特性。益生菌经受(A)SGF(pH 2.0);(B)SIF(pH 6.8);(C)胆盐(3 mg/mL)后的存活率。AKK@GPMGs 在(D)模拟胃肠道和(F)MMP环境中消化过程的SEM图像以及释放曲线。AKK和AKK@PMP在BHI或BHI + 0.05% 粘蛋白培养基中增殖情况。(D)流式细胞仪检测AKK对粘蛋白的内化情况。
体外实验结果见图4,可以发现AKK@GPMGs在SGF、SIF和胆盐中具有良好的抗性,将益生菌在SGF中的存活率提升30.49倍,有效保护了益生菌在胃肠道输送过程中的活力。AKK@GPMGs在模拟的胃肠道环境中保持形态稳定,内部负载的益生菌几乎无释放,而在含有MMP肠液中被迅速裂解,内部负载的益生菌被快速释放出来,在40 min内达到约99.96%的释放率。此外,AKK@PMP在营养匮乏的环境中可为自身的生长提供营养支持,从而为其在营养缺乏的肠炎环境中发挥作用提供了有效保障。
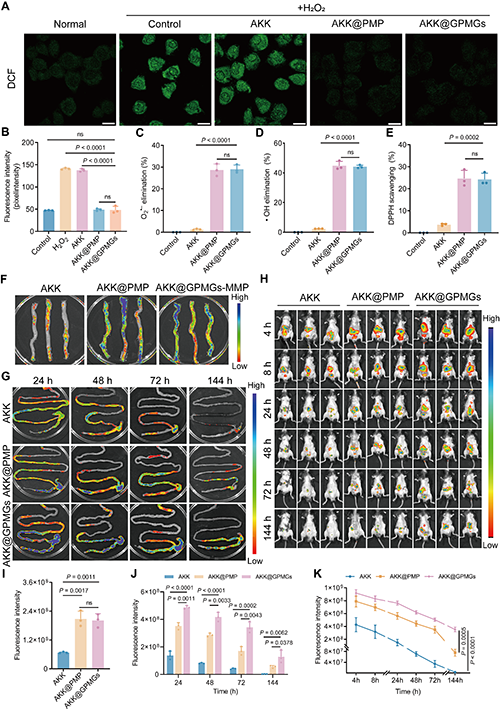
图 5. AKK@GPMGs的ROS清除和粘膜粘附能力。(A)NCM 460 细胞经100μM H2O2 和材料处理后的LSCM图像。(B)DCFH-DA荧光强度定量。(C)O2?-、(D)?OH和(E)DPPH的清除率。小鼠的(F)结肠、(G)肠道荧光和(H)体内生物荧光图像。(I)结肠和(J)肠道的荧光定量。(K)体内荧光强度衰减曲线。
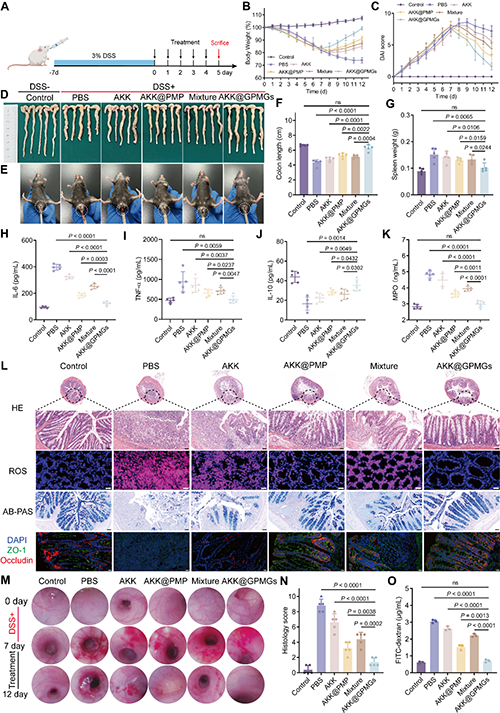
图 6. AKK@GPMGs对DSS诱导的结肠炎的疗效。(A)建模和治疗示意图。(B)小鼠体重变化。(C)DAI 评分。小鼠(D)结肠、(E)肛周照片和(F)结肠长度。(G)脾脏重量。小鼠结肠组织中(H)IL-6、(I)TNF-α、(J)IL-10 和(K)MPO 的表达水平。(L)结肠组织H&E、AB-PAS和ROS图像。(M)结肠内窥镜图像。(N)结肠组织学评分。(O)小鼠血清中FITC-葡聚糖的荧光强度。
此外,AKK@GPMGs能够有效地逆转结肠炎小鼠肠道微生物群失调(图7)。与PBS组相比,AKK@GPMGs组的物种丰富度明显增加。α多样性指数,即香农指数和辛普森多样性指数表明,AKK@GPMGs治疗组与正常小鼠的差异显著缩小,表明AKK@GPMGs有效恢复了肠道微生物的多样性。此外,主坐标分析显示AKK@GPMGs将肠炎小鼠的微生物群特征恢复至与健康小鼠最相似的状态。AKK@GPMGs显著了提高有益微生物的丰度,如包括乳酸菌科、拟杆菌科和疣微菌科,并减少了有害微生物的丰度,如肠杆菌科、脱硫弧菌科以及紫单胞菌科等。
全文链接:https://doi.org/10.1021/acsnano.4c07658
