全自动化诊疗平台是一种及实时监测和及时治疗的闭环系统,它能够实时、精确诊断病情并同步进行治疗,而且在治疗过程中能够监控疗效并随时调整给药方案,有利于达到最佳治疗效果,并减少毒副作用和药物耐药性。其中,响应外界刺激而释放药物的开关是实现精准治疗的关键步骤。具有独特刺激-响应机制的“智能型”药物载体,可在外源型或人体自身环境因素的刺激下做出相关理化性质改变的响应调节,在实现药物靶向释放的同时,自动调节药物释放速率。传统的智能响应系统,如pH响应,温度响应,电场和光响应等药物载体虽具有智能响应药物释放的特点,但由于抗生素药物的亲水性,在施加刺激初期,存在爆发式释放现象,造成药物毒性,在不施加刺激条件时仍会受浓度梯度影响而释放,造成耐药性问题。因此,如何实现药物递送系统的精准控释是亟需解决的医学瓶颈。

近日,西安理工大学汤玉斐教授团队和空军军医大学吴子祥副教授团队联合攻关,设计了一种基于“Lock-ON/OFF”电场(EF)驱动药物释放联合电刺激(ES)治疗PCVE自供电伤口敷料用于加速感染性创面修复(示意图1),并重点研究了的不同孔隙结构和不同刺激条件下的药物释放性能及释药机制。本研究以压电材料聚偏氟乙烯(PVDF)作为自供电体系,以负载盐酸万古霉素的羧基化碳纳米管(c-MWCNTs-VAN)作为电场响应药物释放系统构建了PCVE电场响应药物释放联合电刺激治疗的自供电伤口敷料用于慢性感染伤口修复。此外,考虑到PVDF为疏水材料,药物易被载体封锁在体系内,存在导致药物释放困难的问题。聚氧化乙烯(PEO)被当作软模板,通过水洗处理构建多孔结构,为药物释放提供通道的同时,提高材料压电响应面面积,促进抗菌药物的高效释放。PCVE电场响应药物释放耦合电刺激治疗的自供电伤口敷料可以在人体活动产生的机械应力作用下形成压电电场。该电场,可作为药物释放的开关,释放盐酸万古霉素杀死细菌,调控炎症趋化因子(IL-6, IL-1, TNF-ɑ)下调。同时,还可重塑创面内源性电场,作为生物电刺激信号,调控血管再生,胶原沉积,再上皮化及相关生长因子的表达,加快伤口愈合周期。体外药物释放结果表明,在 EF 的作用下,药物的累积释放率为 88.57%,是没有 EF 作用下(0%)的约 89 倍,实现了药物的精准释放。此外, SD 大鼠皮肤缺损感染模型治疗结果表明,在"Lock-ON/OFF"电场驱动药物释放联合电刺激(ES)治疗下的伤口愈合率是单独 ES 的 1.26 倍,表明 IL-6 下调和 ɑ-SMA 上调具有促进创面修复的作用。因此,本研究所提出的自供电电场响应药物释放联合电刺激治疗的自供电伤口敷料将有望推动远程诊断,无线治疗及按需精准医疗的发展。
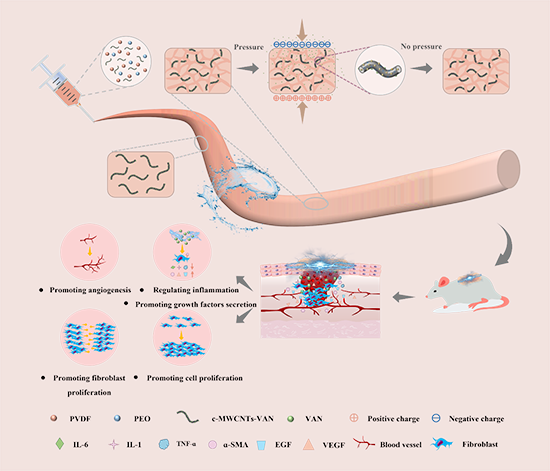
示意图1、 用于加速感染性创面修复的基于“Lock-ON/OFF”EF驱动药物释放联合电刺激治疗PCVE自供电伤口敷料的制备及应用示意图
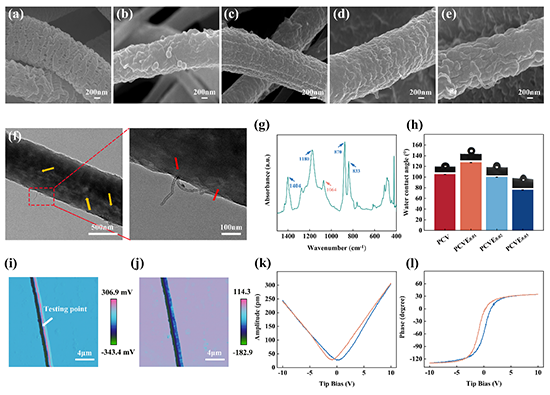
图1、PCVE自供电伤口敷料的理化特性(a)添加3wt%的PEO并结合去离子水洗处理对PVDF表面形态的影响,加入c-MWCNTs-VAN后,PEO含量对自供电伤口敷料表面形态的影响,(b)PCV、(c)PCVE0.01、(d)PCVE0.02和(e)PCVE0.03扫描电镜图像,PEO含量为0、1、2和3wt%的伤口敷料分别命名为PCV、PCVE0.01、PCVE0.02和PCVE0.03。(f)PCVE0.03的TEM图像,PCVE0.03多孔压电纤维中嵌入的c-MWCNTs-VAN用红色箭头表示。(g)水洗后 PCVE0.03 的傅立叶变换红外光谱。(h) PEO 含量对自供电伤口敷料亲水性能的影响。PCVE0.03的PFM图像(i)振幅图,(j)相图,(k)振幅蝶形环和(l)相位滞后环。
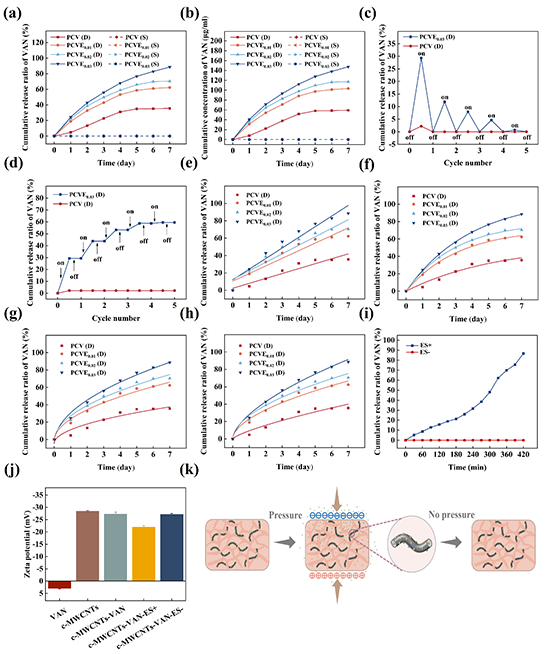
图2、PCV、PCVE0.01、PCVE0.02和PCVE0.03在动态和静态负载下的EF驱动药物释放性能和释放动力学分析。(a)PCV、PCVE0.01、PCVE0.02和PCVE0.03在不同负载条件下VAN的累积释放率和(b)累积释放浓度。(c)在循环动态加载下,PCV和PCVE0.03的VAN释放率,(d)累积释放率。不同数学模型拟合下的释放动力学分析(e)零级方程、(f)一级方程、(g)Higuchi方程和(h)Korsmeyer-Peppas方程。(i)c-MWCNTs-VAN纳米粒子在施加5V电刺激和无电刺激下的药物累积释放曲线。(j)施加ES前后VAN、c-MWCNTs、c-MWCNTs-VAN纳米粒子的Zeta电位。(k)自供电电场作用下的药物释放机制示意图。
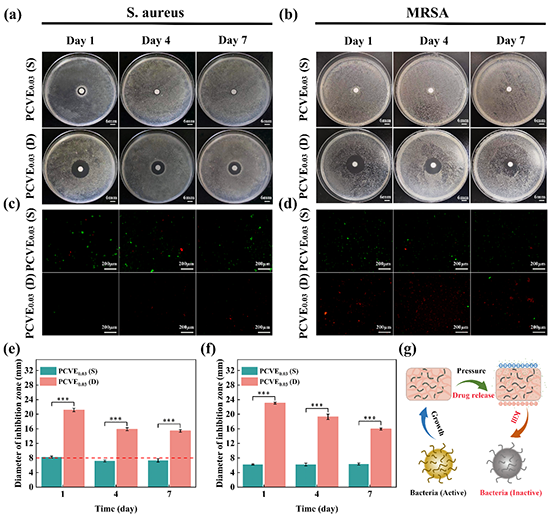
图3、自供电伤口敷料的体外抗菌活性评估。琼脂平板上的(a,e)S.aureus和(b,f)MRSA与吸附药物溶液的滤纸片共存24小时后的图像和定量数据。上述药物溶液分别是PCVE0.03(S)和PCVE0.03(D)在第1、4和7天释放的药物溶液。(c)S.aureus和(d)MRSA与吸附药物溶液的滤纸片共存24小时后的AO/EB双荧光染色荧光显微镜图像。(绿色:活菌;红色:死菌)。(g)盐酸万古霉素的抑菌机制示意图。(n=3,mean ±SD,*p<0.05,**p<0.01,***p<0.001)。
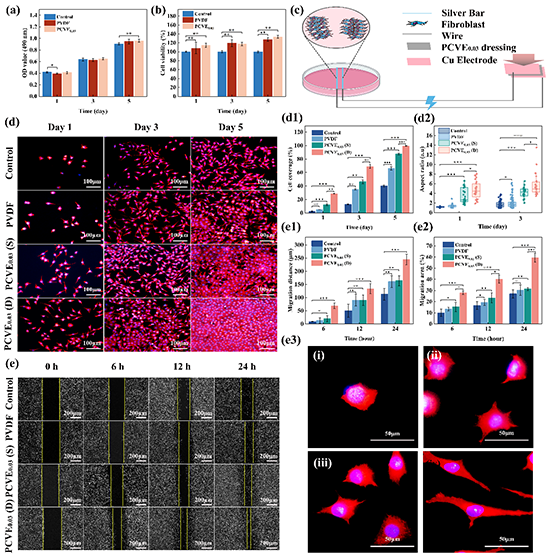
图4、体外细胞毒性、细胞粘附、增殖和迁移活性。(a)细胞毒性,(b)细胞活力。(c)动态加载下的细胞划痕实验示意图。(d)各组成纤维细胞粘附和增殖的荧光图像(红色表示细胞质,蓝色表示细胞核),(d1)第1、3和5天的细胞覆盖率,(d2)第1和3天的细胞长径比。(e)不同组电刺激作用下成纤维细胞的增殖和迁移活性,(e1)细胞迁移距离,(e2)细胞迁移面积,(e3),成纤维细胞在不同组电刺激作用下生长形态的荧光图像。(i:对照组;ii:PVDF;iii:PCVE0.03(S);iv:PCVE0.03(D))。(n=3,mean ±SD,*p<0.05,**p<0.01,***p<0.001)。

图5、自供电伤口敷料对感染性伤口的体内治疗效果评价。(a)SD大鼠感染性伤口模型的构建及治疗流程图。(b)第0、4、7和10天不同治疗方式下伤口的代表性照片,(c)伤口愈合过程示意图,(d)伤口愈合率。(e)PCVE0.03(D)的伤口愈合率与近期类似伤口敷料报道的伤口愈合率对比图。(n=3,mean ±SD,*p<0.05,**p<0.01,***p<0.001)。
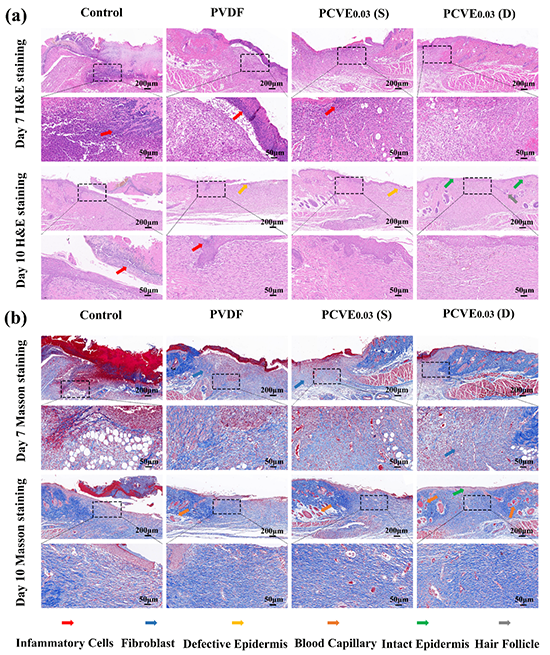
图6、第7和10天不同治疗方式治疗后创面组织的病理学分析。对照组、PVDF组、PCVE0.03(S)组和PCVE0.03(D)组在第7天和第10天的(a)H&E和(b)Masson染色伤口组织显微照片。
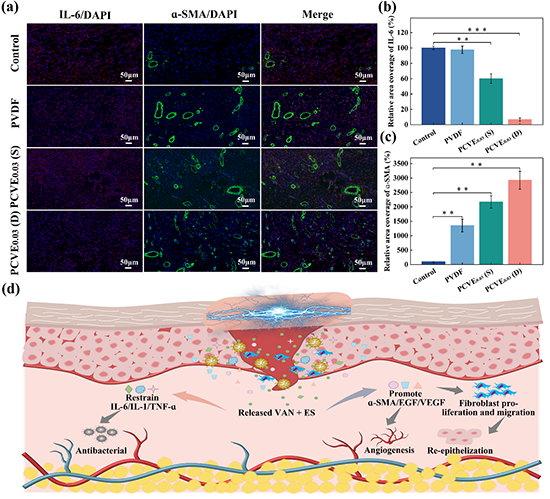
图7、第7天不同组伤口组织中IL-6和ɑ-SMA的免疫荧光染色显微照片(a)和定量数据(b,c)。(d)基于“Lock-ON/OFF”电场驱动药物释放联合电刺激疗自供电伤口敷料用于加入感染性创面修复的愈合机制示意图。(n=3,mean ±SD,*p<0.05,**p<0.01,***p<0.001)。
相关研究成果以“A Self-Powered Wound Dressing Based on “Lock-ON/OFF” Drug Release Combined Electric Stimulus Therapy for Accelerated Infected Wound Healing”为题发表在国际著名期刊《Advanced Functional Materials》(IF:19.0,中科院TOP期刊)上。西安理工大学孙雅妮博士为论文第一作者,西安理工大学汤玉斐教授、空军军医大学西京医院吴子祥副教授为论文共同通讯作者,合作者还包括西安理工大学赵康教授和严富学副教授。该工作得到国家自然科学基金和陕西省自然科学基础研究计划的资助与支持。
论文信息:
Yani Sun, Yufei Tang,* Yuxuan He, Lei Chen, Cong Wu, Bo Zhang, Fuxue Yan, Kang Zhao, and Zixiang Wu*. A Self-Powered Wound Dressing Based on “Lock-ON/OFF” Drug Release Combined Electric Stimulus Therapy for Accelerated Infected Wound Healing. Adv. Funct. Mater, 2024, 2315086.
https://doi.org/10.1002/adfm.202315086









