结直肠癌(CRC)是发生在结直肠部位的消化道恶性肿瘤,其全球死亡率在恶性肿瘤中高居第二位。对于CRC中晚期患者来说化疗仍是主要治疗策略。然而,化疗耐药性导致的复发和转移,使得化疗的疗效面临严峻挑战。越来越多的证据表明:CRC化疗后的复发与一种特定的肠道微生物-具核梭杆菌(Fn)密切相关。Fn能够通过其表面的凝集素Fap2与CRC细胞表面过度表达的Gal-GalNAc特异性结合黏附到CRC细胞,而CRC部位Fn的异常增殖会促进肿瘤的发展和转移,诱导CRC细胞产生化疗耐药性。因此针对Fn进行靶向干预,减少其在肿瘤组织内的定植,有望显著增强化疗的治疗效果,并降低癌症复发的风险。
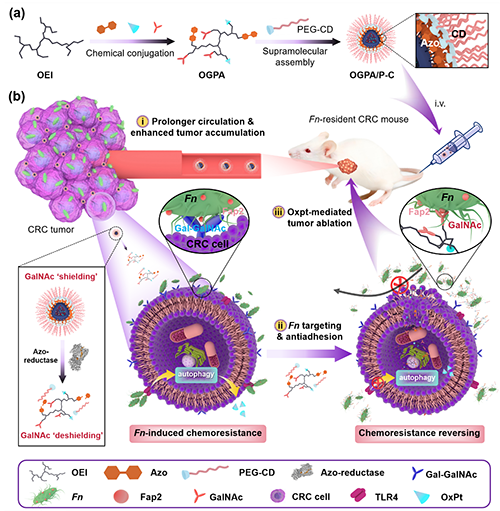
图1. GalNAc衍生的抗黏附纳米平台通过阻断Fn-宿主相互作用以增强CRC化疗的示意图。(a)OGPA的制备及其与PEG-CD通过超分子自组装得到OGPA/P-C。(b)OGPA/P-C对Fn感染的CRC的治疗机制:i)屏蔽GalNAc介导的肝脏靶向作用、延长纳米药物的血液循环时间并增强其在肿瘤组织的蓄积;ii)在CRC相关偶氮还原酶触发下暴露GalNAc靶向Fn,干扰Fap2-Gal-GalNAc相互作用,从而阻断Fn与CRC细胞的黏附,逆转Fn诱导的化疗耐药性。iii)局部释放化疗药物OxPt,有效消融CRC肿瘤。

图2. GalNAc衍生的抗黏附纳米平台的合成与表征。(a)OGPA/P-C的制备示意图。(b)OGPA和OGPA/P-C的紫外可见光谱。(c)通过DLS测定在有/无Na2S2O4情况下OGPA/P-C纳米平台的水合粒径分布。(d)OGPA/P-C的SEM图像。(e)OGPA/P-C纳米平台在10%血清溶液中培养后的水合粒径和PDI。(f)Na2S2O4存在(蓝线)和不存在(红线)时OGPA/P-C纳米平台的紫外可见光谱。(g)在有/无Na2S2O4情况下,Pt从OGPA/P-C纳米平台中的累积释放曲线。
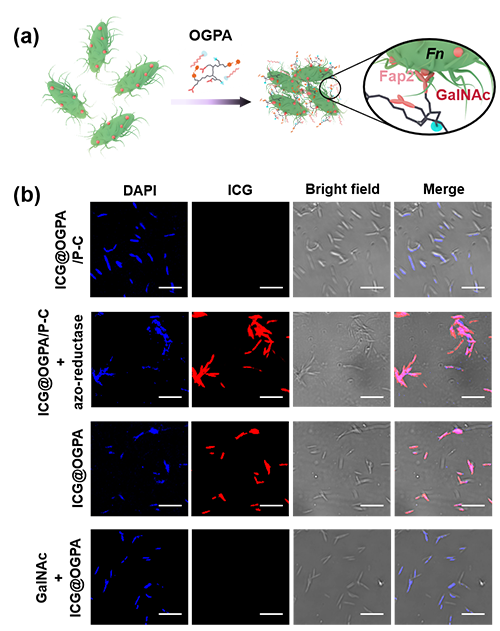
接下来研究人员在体外测定了OPGA/P-C对Fn黏附肿瘤细胞的抑制作用(图4a)。结果表明,CT26和HCT116两种细胞都有较高的Gal-GalNAc表达水平,并且GalNAc和GalNAc衍生的纳米平台都具有抑制Fn在CT26和HCT116细胞表面定植的能力(图4b-i)。
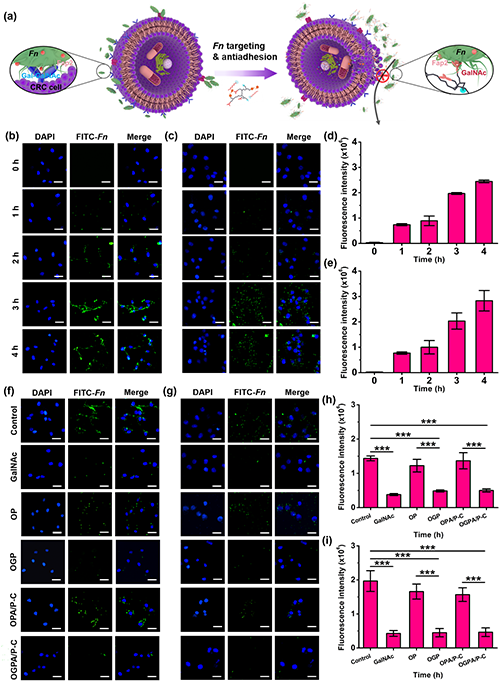
图4. 体外抑制Fn黏附CRC细胞。(a)OGPA/P-C阻断Fn黏附CRC细胞示意图。(b)CLSM图像显示FITC标记的Fn与CT26和(c)HCT116细胞的黏附情况。(d-e)FITC荧光定量分析。(f)CLSM图像显示CT26和(g)HCT116细胞经不同样品处理后Fn的黏附情况。(h-i)FITC荧光定量分析。
为了进一步验证GalNAc是否可以通过抑制Fn对CRC细胞的黏附从而逆转CRC细胞的化疗耐药性,在Fn感染的细胞模型中评估了纳米平台的抗肿瘤活性。结果显示OxPt对Fn感染细胞的细胞毒性显著降低,即Fn可诱导HCT116和CT26细胞对OxPt产生化学耐药性。然而,在加入游离的GalNAc以后,CT26/Fn和HCT16/Fn组细胞的存活率均有所下降,并且随着GalNAc浓度的不断增加,细胞的存活率呈现出比较明显的下降趋势,该结果表明GalNAc可以克服Fn诱导的CRC耐药性(图5a-b)。随后进一步研究了OGPA/P-C对Fn感染的CRC细胞的作用。如图5c-d所示,用含有GalNAc的OGP和OGPA/P-C处理Fn感染的CT26和HCT116细胞后,其细胞活力低于不含GalNAc的OP和OPA/P-C,该结果表明GalNAc衍生的纳米平台可通过阻断Fn-宿主细胞间的相互作用有效逆转CRC细胞的耐药性。研究表明,Fn通过激活自噬途径诱导CRC的化疗耐药性,进一步损害化疗效果。因此研究人员使用AO染色法和蛋白印迹法评估了Fn感染的CT26细胞在不同组分处理后的自噬活性。结果表明Fn会诱导CT26细胞发生自噬,而用OGPA/P-C处理Fn感染的CT26细胞后,其自噬活性显著降低(图5e-f)。即OGPA/P-C通过阻断Fn对CRC细胞的黏附可有效抑制Fn诱导的自噬激活进而克服化疗耐药性(图5g)。
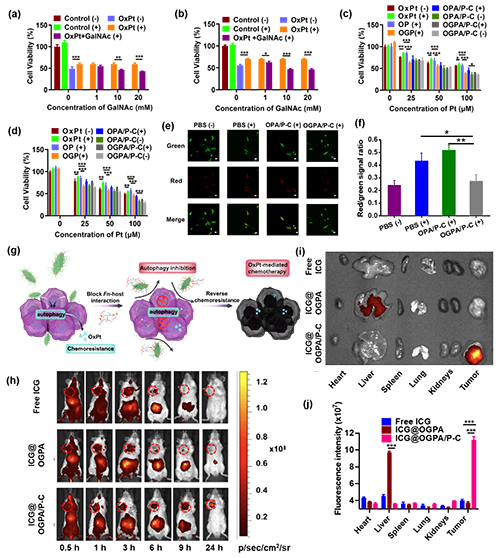
图5. 体外抗肿瘤活性和体内生物分布评估。(a)OxPt和GalNAc对CT26和Fn感染的CT26细胞的细胞毒性。(b)OxPt和GalNAc对HCT116和Fn感染的HCT116细胞的细胞毒性。(c)含有不同Pt浓度的样品对CT26和Fn感染的CT26细胞的细胞毒性。(d)不同Pt浓度(0-100 μM)的样品对HCT116和Fn感染的HCT116细胞的细胞毒性。(e)经PBS、OPA/P-C和OGPA/P-C处理后,Fn感染CT26细胞的AO染色图像。(f)相应的红绿比定量分析。(g)OGPA/P-C通过阻断Fn-宿主相互作用和抑制自噬激活来恢复OxPt活性示意图。(h)ICG、ICG@OGPA和ICG@OGPA/P-C经尾静脉注射到携带CT26肿瘤的BALB/c小鼠体内后0.5、1、3、6、9和24小时的生物分布(n = 3)。(i)体内成像和(j)给药后24小时离体器官和肿瘤中ICG的荧光定量分析。

图6. 抗黏附和体内抗肿瘤性能。(a)小鼠接种肿瘤细胞和治疗示意图。(b)不同治疗后小鼠肿瘤生长曲线(n = 6)。(c)治疗15天后切除肿瘤的代表性照片。(d)不同样品治疗后小鼠在40天内的存活率。其中(+)和(-)指静脉注射Fn与否。(e)具有代表性的肿瘤切片免疫组化染色。(f)不同样品治疗后小鼠体重的变化。(g)小鼠在不同样品治疗后主要器官和肿瘤的代表性H&E染色图像。
总之,该研究团队成功开发了一种非致死性策略,通过利用GalNAc衍生的抗黏附纳米平台(OGPA/P-C)特异性阻断Fn-宿主细胞相互作用来逆转Fn诱导的化疗耐药性,从而增强Fn相关CRC的化疗效果。该团队提出的非致死性抗黏附策略为提高Fn感染的CRC和其他实体瘤的化疗效果提供了一种创新思路。
文章链接:https://doi.org/10.1016/j.nantod.2024.102288
- 杭师大黄又举/丁彩萍团队 ACS Nano:铂基超晶格生物探针赋予生物传感器“阈值特异性”实现结核性脑膜炎准确评估 2026-02-10
- 四川大学丁明明/薛建新《Adv. Mater.》:铜驱动变构自封装聚合物用于肿瘤特异性成像和治疗 2025-10-13
- 暨南大学戴箭课题组 Adv. Funct. Mater.:溶瘤病毒样纳米颗粒用于肿瘤特异性基因递送 2024-04-23
- 四川大学王云兵教授团队 Biomaterials: 聚合物分子刷修饰生物瓣膜功能化改性策略研究 2023-03-08
- 华东理工刘润辉教授课题组《Nat. Commun.》:仿生启发的新一代抗植入异物反应高分子材料 2021-09-08
- 广州大学林璟团队《CEJ》:实现含细菌/染料/油复杂污水的一步分离和分离膜抗污染策略 2021-05-25
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
