黑色素瘤是一种起源于黑色素细胞的恶性皮肤肿瘤,易转移,侵袭性强,生存率低因此,一种简单、可行、高效的治疗策略仍然是该领域的一项艰巨挑战。智能可穿戴生物贴片为皮肤肿瘤治疗提供了一种很有前途的辅助方法,即通过外部刺激引发不可逆的肿瘤细胞损伤。到目前为止,各种自供电的贴片和基于焦耳热的热疗已经被开发用于皮肤肿瘤治疗。然而,目前报道的贴片大多结构复杂,制作工艺复杂,对设备要求高,制备难度大,制备成本高,耗时长。这些缺点限制了其潜在的临床应用,因此迫切需要开发一种简单,多响应和可穿戴的贴片来有效治疗黑色素瘤。

在eT-patch应用于皮肤肿瘤治疗之前,检测并揭示了光电刺激对B16F10细胞的作用和细胞死亡机制。首先用不同的方法处理B16F10细胞,结果表明,PES处理的细胞杀伤效果明显强于其他处理方式(图2a和2b)。如图2c所示,与对照组相比,PES处理后B16F10细胞内焦亡标志物(GSDME、Caspase-3、IL-1β)和凋亡标志物(Bax、c-Jun、Cyt-c)的基因表达显著升高。为了进一步证实ES触发了焦亡,在不同处理后使用商用试剂盒检测了经典的焦亡生物标志物乳酸脱氢酶(LDH)释放水平。如图2d所示,PES和ES组B16F10细胞的LDH释放水平明显高于其他组。同时,发现PES处理后B16F10细胞内ATP水平低于其他处理(图2e)。此外,从生物透射电镜图像中观察到明显的线粒体破坏,明显的空化和肿胀,这些结果表明了线粒体功能障碍(图2f)。此外,使用2,7 -二氯二氢荧光素二乙酸酯(DCFH-DA)检测B16F10细胞内的ROS水平,DCFH-DA在ROS存在下可水解生成DCFH。它们在细胞内部扩散并被非特异性氧自由基氧化,生成绿色荧光DCF。如图2g所示,PTT和ES组B16F10细胞可见明显的绿色荧光成像。而B16F10细胞在激光和电共同刺激后,由于细胞膜破裂,呈现微弱的绿色荧光图像。由于线粒体膜电位对于维持细胞线粒体功能具有重要作用,而MMP的降低通常与ROS的积累有关,因此使用JC-1检测试剂盒检测不同处理后细胞内的MMP(图2g),结果证实PES处理后细胞内的MMP显著降低,导致红色荧光消失,绿色荧光产生。我们随后使用γ-H2AX免疫荧光染色来研究不同处理后可能发生的DNA双链断裂。如图2h所示,PES处理组DNA损伤程度最高,这间接证实了PES处理产生了更高水平的ROS,产生的ROS可以严重损伤细胞核内的DNA。
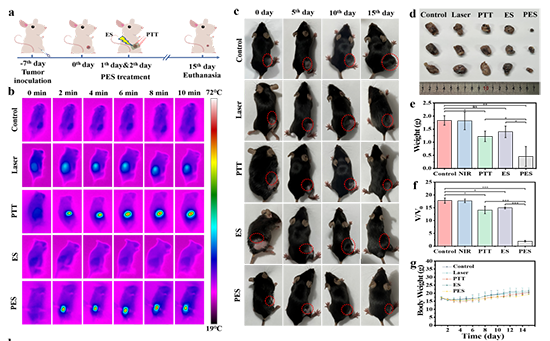
图 3. a、B16F10荷瘤小鼠模型建立及治疗过程示意图。b,不同处理荷瘤小鼠不同时间的热像图。c、荷瘤小鼠在不同治疗过程中不同天数(第5天、第10天、第15天)的代表性照片。红圈代表黑色素瘤。d,治疗第15天小鼠解剖肿瘤的照片。e, f,治疗15 天后各组切除肿瘤重量及相对体积。g,不同组荷瘤小鼠体重曲线。
原文链接:https://www.nature.com/articles/s41467-024-45070-z
- 杭师大朱雨田教授团队《Chem. Eng. J》:具有温度和应变传感功能的柔性高透明离子凝胶 2021-05-31
- 武培怡教授团队《Mater. Horiz.》:力学性能自增强的高透明离子凝胶用于水下超强粘附 2021-05-15
- 中科院理化所江雷院士团队:基于氢键的高强度、超稳定的透明离子凝胶 2019-12-16
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
- 西工程大樊威教授/西安交大王淑娟教授 Adv. Mater.:“一纤双色”力致发光纤维问世 - 可穿戴设备迎来“无电发光”新突破 2025-11-21
- 陕科大王学川/刘新华 AFM:埃洛石纳米管与天然皮肤的界面分子调控 - 用于先进辐射冷却与能量收集的仿生可穿戴材料 2025-11-17
- 巴黎高科化学学院李敏慧教授 AFM 综述:电刺激响应液晶弹性体作为软驱动器 2025-11-14
