骨关节炎(OA)是一种常见的慢性关节疾病,其主要特征为软骨损伤、滑液润滑减少和关节摩擦增加。在OA的早期阶段,软骨损伤会引起的关节摩擦增加,进而加剧了软骨细胞基因的异常表达,触发了一系列相关的生物反应,包括基质降解酶的释放、促炎细胞因子的分泌,以及细胞的沉默或衰老等。成纤维细胞生长因子18(FGF18)是OA发展中被异常沉默的关键基因之一,在软骨再生过程中对细胞增殖和分化具有至关重要的作用。研究发现,FGF18能够抑制OA的发展,并在各种动物模型中展现出良好的软骨损伤愈合能力。目前,人源重组FGF18(也称为sprifermin)正在进行关节应用的临床试验。然而,作为一种蛋白质药物,sprifermin面临着一些挑战,包括其半衰期短、递送效率低,以及需要反复进行关节注射等问题。因此,寻找新的治疗策略以克服这些挑战,对于改善OA患者的生活质量具有重要意义。
针对以上问题,四川大学张兴栋院士团队王启光/樊渝江报道了一种基于CRISPR/Cas9在体基因编辑的方法,利用可特异性靶向软骨细胞的杂化外泌体(CAP/FGF18-hyEXO)装载FGF18基因编辑工具,有效地在体内基因组层面激活OA软骨细胞的FGF18基因。在此基础上,利用微流控和光聚合技术将其包封于甲基丙烯酸酐修饰的透明质酸(HAMA)可注射性微凝胶中,通过脂质边界效应形成自我更新的水合层,为运动时的关节摩擦提供持久的润滑作用。研究发现,结合体内FGF18基因编辑和持续润滑可协同促进软骨再生、减轻炎症和防止软骨基质降解,具有较大的临床应用潜力。该工作以“Injectable microgels with hybrid exosomes of chondrocyte-targeted FGF18 gene-editing and self-renewable lubrication for osteoarthritis therapy”在国际权威期刊Advanced Materials上发表。王启光副研究员和樊渝江教授为该文的通讯作者,四川大学生物医学工程学院博士生陈曼雨为文章第一作者。这项研究得到了国家自然科学基金委面上项目(32071353)的支持。
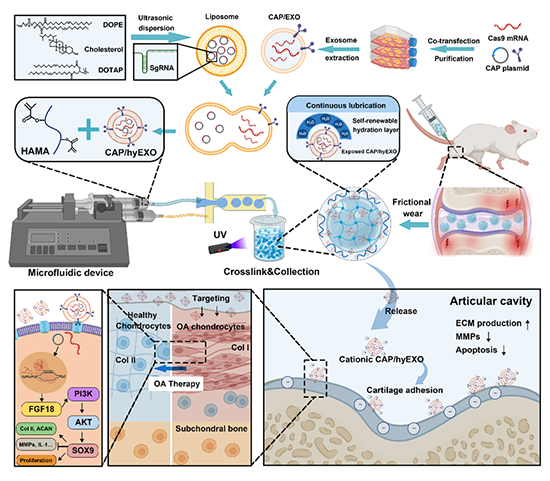
图1 具有软骨细胞靶向性在体FGF18基因编辑和自我再生润滑功能的可注射性杂化外泌体微凝胶用于骨关节炎治疗的示意图
为实现FGF18的精准在体编辑,研究团队首先转染并筛选出稳定表达CAP/EGFP-Lamp2b质粒与Cas9质粒的HEK293细胞,并通过超高速离心得到该细胞的外泌体CAP/EXO。接着,通过膜融合将CAP/EXO与负载SgFGF18的脂质体进行杂化,构建了负载FGF18基因编辑工具的杂化外泌体CAP/hyEXO(图1)。制备的CAP/hyEXO的粒径大小与细胞外泌体CAP/EXO相似(约150-220 nm),呈现出球形囊泡的形态,并保留了外泌体的特异性膜蛋白,同时显示出优秀的稳定性。细胞实验表明,CAP/FGF18-hyEXO可显著提高软骨细胞中FGF18基因的表达,证明了Cas9-SgFGF18具有有效的FGF18基因调控能力(图2)。

图2. CAP/hyEXOs的制备和表征
研究人员利用基因工程技术成功实现了软骨亲和肽CAP对杂化外泌体CAP/hyEXO的修饰,以确保Cas9-SgFGF18在体内精准递送至软骨细胞。通过活体成像追踪CAP/hyEXO在关节部位的滞留情况,发现CAP/FGF18-hyEXO在关节腔内留存长达7天,并且不会脱靶积聚在其他器官中(图3)。CAP/hyEXO表面微弱的正电荷特性,也间接地增强了其关节内的靶向能力:由于分子静电力作用,促使更多的CAP/hyEXO粘附聚集于带负电荷的关节表面,并进一步固定在软骨组织内带负电的糖胺聚糖链接(图3)。
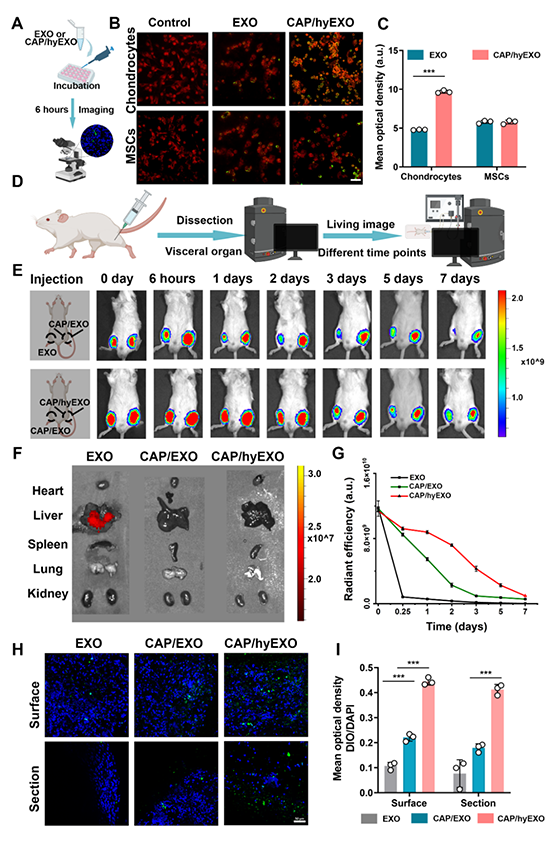
图3. CAP/hyEXOs的体内外细胞靶向性研究
随后,研究人员利用微流控和光聚合技术将杂化外泌体CAP/hyEXO包封于甲基丙烯酸酐修饰的透明质酸(HAMA)为基体材料的微凝胶中,获得了CAP/hyEXO均匀分散、平均粒径为189.82±19.53μm的可注射微凝胶CAP/hyEXO@HMs。其中,CAP/hyEXO表面的阳离子和透明质酸聚合物链中的阴离子的通过静电分子力形成的紧密的网络结构,实现了CAP/hyEXO的缓慢释放和CAP/hyEXO@HMs缓慢降解,延长在关节内的作用时间(图4)。同时,与透明质酸微球相比,可注射性微凝胶CAP/hyEXO@HMs在往复摩擦磨损试验中能保持稳定的低摩擦系数(COF≈0.2)。CAP/hyEXO@HMs优异的润滑性能主要归因于脂质边界效应机制:CAP/EXO@HMs可作为CAP/hyEXO的储存层,在磨损过程中导致CAP/hyEXO的不断暴露,可实现稳定的水润滑。CAP/hyEXO@HMs优异的润滑性能,能有效减轻关节磨损(图4)。

图4. 可注射CAP/hyEXO@HMs微凝胶的制备和表征
进一步地,利用IL-1β诱导的OA软骨细胞模型研究了CAP/hyEXO@HMs对OA软骨细胞的治疗作用。体外细胞实验表明,CAP/hyEXO@HMs具有良好的细胞相容性,能够促进OA软骨细胞增殖、迁移、软骨相关基质分泌和ECM合成(图6),并利用分子生物学手段,进一步揭示了CAP/++FGF18-hyEXO@HMs对OA软骨细胞的治疗的作用机制,发现通过FGF18上调激活了PI3K/AKT信号通路,从而促进ECM再生,同时抑制炎症和基质降解(图6)。
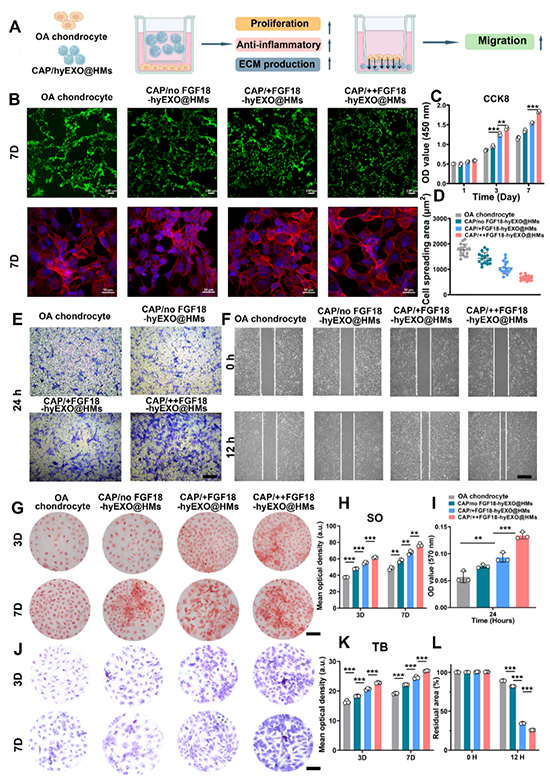
图5.CAP/++FGF18-hyEXO@HMs促进OA软骨细胞的增殖、迁移和ECM合成
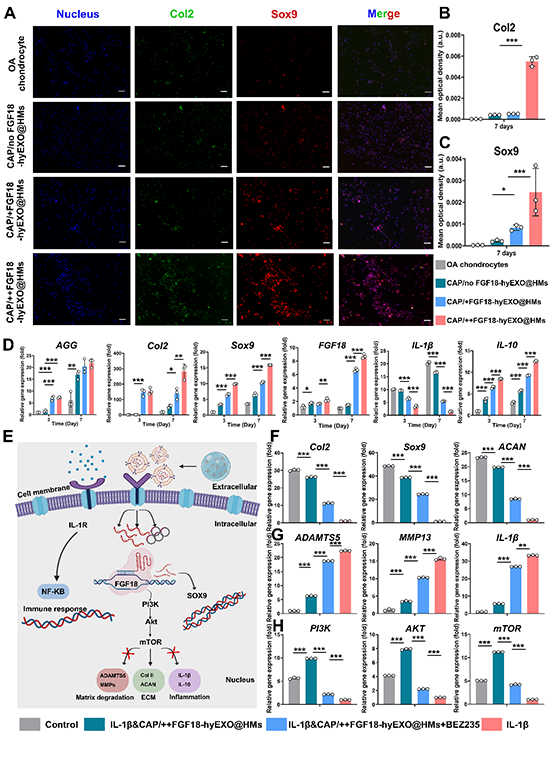
图6.CAP/++FGF18-hyEXO@HMs通过调控PI3K/ATK信号通路促进OA软骨细胞再生软骨基质
为评价 CAP/++FGF18-hyEXO@HMs的体内治疗效果,研究人员在基于ACLT法建立的大鼠膝关节OA模型中进行了关节腔注射,并于术后8周和12周进行了影像学和组织学分析。结果显示,CAP/++FGF18-hyEXO@HMs组的骨赘形成少,软骨基质再生增加,与软骨ECM蛋白、炎症、基质降解和PI3K信号通路相关的特定基因表达增强(图7)。同时,通过转录组学分析,进一步地确认了CAP/++FGF18-hyEXO@HMs的体内FGF18基因编辑和持续润滑在关节炎治疗中的协同作用,并探索了相关的作用机理(图8),有利于在未来的研究中进一步开发和优化基于在体基因编辑的骨关节炎治疗方案。

图7 可注射CAP/++FGF18-hyEXO@HMs微凝胶治疗OA大鼠的效果表征
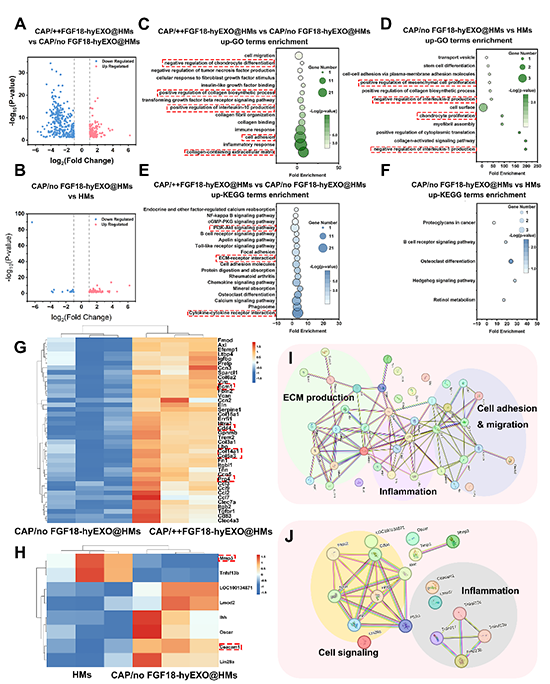
图8可注射CAP/++FGF18-hyEXO@HMs微凝胶治疗OA大鼠的转录组分析
这项工作是该团队近期对工程化外泌体平台构建的最新进展之一。该研究创新性地采用基于CRISPR的基因疗法和微流控技术制备了一种可注射的CAP/FGF18-hyEXO@HMs,具有高效的体内FGF18基因编辑和持续润滑功能,有望解决人源重组FGF18蛋白质药物的半衰期短、递送效率低,并需要反复关节注射等因缺陷。CAP/FGF18-hyEXO@HMs在体外和体内均显示出协同促进软骨再生、减轻炎症和防止ECM降解的能力。本研究为基于CRIPSR基因编辑的OA治疗提供了新思路,有望进一步应用于骨关节炎的临床治疗中。
论文信息:Manyu Chen, Yan Lu, Yuhan Liu, Quanying Liu, Siyan Deng, Yuan Liu, Xiaolin Cui, Jie Liang, Xingdong Zhang, Yujiang Fan, Qiguang Wang, Injectable Microgels with Hybrid Exosomes of Chondrocyte-Targeted FGF18 Gene-Editing and Self-Renewable Lubrication for Osteoarthritis Therapy. Adv. Mater. 2024, 2312559.
https://doi.org/10.1002/adma.202312559








